Стабилизация микротрубочек может лечь в основу терапии бокового амиотрофического склероза
Американские исследователи предложили потенциальный подход к терапии бокового амиотрофического склероза (БАС). Они установили, что потеря функции киназы NEK1 — один из механизмов развития БАС — дестабилизирует цитоскелет моторных нейронов и нарушает импорт белков в ядро. Эти механизмы и регулирующая их киназа могут оказаться перспективными мишенями для терапии.
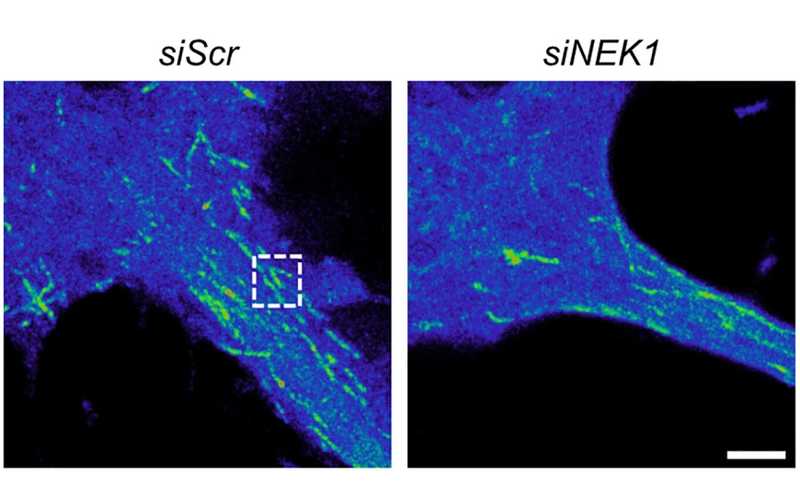
Динамика микротрубочек в мотонейронах демонстрирует, что при нокдауне NEK1 (справа) полимеризация происходит менее активно, чем в контроле (слева).
Credit:
Science Advances (2023). DOI:
10.1126/sciadv.adi5548 |
CC BY
Боковой амиотрофический склероз (БАС) — нейродегенеративное заболевание, которое характеризуется дисфункцией и дегенерацией двигательных нейронов. Одной из его генетических причин являются мутации киназы NEK1 (NIMA-related kinase 1), однако механизм, по которому они нарушают работу мотонейронов, пока не был выяснен. Исследователи из США проанализировали внутриклеточные взаимодействия этого белка и описали его регуляторную роль, сбой в которой приводит к дегенерации двигательных нейронов.
На модельных мотонейронах, полученных из индуцированных плюрипотентных стволовых клеток (iPSC), группа под руководством ученых из Чикаго установила, с какими белками в клетке взаимодействует NEK1. С помощью коимунопреципитации (CoIP) и вестерн-блоттинга авторы работы выделили несколько групп таких белков. Первая из них, ассоциированная с цитоскелетом, включала α-тубулин (TUBA1B, основной структурный компонент микротрубочек), фактор элонгации 1-α (EF1α), стабилизирующий микротрубочки, миозин 9 и виментин — белок промежуточных филаментов. Также ученые выявили взаимодействие NEK с импортинами, отвечающими за перенос различных белков в ядро. Еще одна функциональная группа — в нее входят белки теплового шока и убиквитин — участвует в поддержании белкового гомеостаза клетки.
Исследователи также смоделировали в мотонейронах дефицит NEK1, свойственный пациентам с NEK1-ассоциированной формой БАС. Оказалось, что частичный (на 50–60%) нокдаун NEK1 изменял экспрессию ряда белков. Анализ дифференциальной экспрессии показал, что в мотонейронах возрастало количество тубулин-связывающих белков и белков, регулирующих связанные с микротрубочками процессы. При этом уровень участников белкового импорта, сплайсинга РНК и связывания мРНК снижался.
Затем авторы сфокусировались на ключевых участниках двух процессов: поддержании гомеостаза и ядерно-цитоплазматического транспорта. Они проанализировали участие NEK1 в прямой регуляции α-тубулина и импортина-β1 (KPNB1). Оказалось, что NEK1 взаимодействует с этими белками и фосфорилирует их in vitro. Затем авторы воспользовались в качестве метки фотоконвертируемым белком, который при освещении ультрафиолетом меняет цвет флуоресценции с зеленого на красный. Они сшили этот белок с α-тубулином, чтобы отследить его динамику в клетке. Таким способом ученые выяснили, что дефицит NEK1 нарушает полимеризацию микротрубочек в модельных нейронах.
Кроме того, нейроны, в которых был снижен уровень NEK1, хуже восстанавливали отростки после их повреждения. Аналогичным образом на регенерацию действовало и ингибирование активности NEK1.
Помимо гомеостаза микротрубочек дефицит NEK1 нарушал и транспорт белков между ядром и цитоплазмой. В модельных мотонейронах, полученных из iPSC здоровых доноров, после нокдауна этой киназы существенно снижался уровень KPNB1 в ядре и в области ядерной оболочки. Ученые подтвердили эту закономерность и на посмертных образцах: нейроны существенной части пациентов с NEK1-ассоциированной формой БАС были почти лишены KPNB1 в ядре и ядерной оболочке, чего не наблюдалось в контрольных образцах.
Дальнейший анализ показал, что при нокдауне NEK1 в мотонейронах значительно снижалась скорость ядерного импорта. Чтобы установить это, исследователи пометили флуоресцентный белок tdTomato сигналом ядерной локализации (NLS) и экспорта из ядра (NES) и отслеживали его транспорт с помощью прижизненной флуоресцентной микроскопии. Дефицит NEK1 затрагивал также эндогенные карго-белки, переносимые в ядро KPNB1/KPNB2. Эти данные свидетельствуют о том, что потеря функции NEK1 нарушает опосредованный KPNB1/KPNA2 ядерный импорт.
Наконец, авторы изучили роль NEK1 на in vivo модели D. melanogaster. Для этого они провели нокдаун Niki, гомолога этого белка у дрозофилы, в мотонейронах модельных мушек. Скорость и дальность перемещения дрозофил при нокауте Niki значимо снижалась. Кроме того, нокдаун сокращал их продолжительность жизни. Это подтверждает, что гомолог человеческого NEK1 необходим для нормального функционирования нервной системы плодовых мушек. При этом нарушения моторной функции при нокауте Niki частично компенсировала оверэкспрессия α-тубулина.
Помимо изучения механизмов, нарушающих функции нейронов при NEK1-ассоциированной форме БАС, исследователи также задались вопросом о стратегиях терапии. На клеточной модели они установили, что стабилизация микротрубочек в моторных нейронах улучшает ядерный импорт белков. Чтобы подтвердить это, авторы работы обрабатывали модельные мотонейроны паклитакселом — это противораковый препарат, стабилизирующий микротрубочки. Их стабилизация действительно усиливала импорт белков в ядро, однако этот эффект паклитаксела распространялся и на контрольные клетки. При этом возрастание уровня NEK1 наблюдалось только в контрольных, но не в мутантных мотонейронах, и ингибирование активности этой киназы в таком случае возвращало импорт белков в исходному уровню. Эти данные подтверждают роль киназы NEK1 в регуляции ядерного импорта, нарушения которого ассоциированы с БАС.
Исследователи заключают: киназа NEK1 модулирует два внутриклеточных пути, нарушения которых участвуют в патогенезе бокового амиотрофического склероза: гомеостаз микротрубочек и импорт белков в ядро. Кроме того, опыты на клеточной модели указывают на то, что стабилизация микротрубочек восстанавливает также и транспорт через ядерную мембрану, хотя эти результаты и являются предварительными. «Это позволяет предположить, что стабилизация микротрубочек может стать рациональным подходом к терапии БАС» — поясняет доктор Эвангелос Кискинис, ведущий автор исследования.
Цитата по пресс-релизу
Малая молекула компенсирует патогенный сплайсинг при боковом амиотрофическом склерозе
Источник
Jacob R. Mann et al. Loss of function of the ALS-associated NEK1 kinase disrupts microtubule homeostasis and nuclear import. // Science Advances 9, eadi5548 (2023). DOI: 10.1126/sciadv.adi5548


 Меню
Меню





 Все темы
Все темы




 0
0







