Связывание внеклеточных везикул с ламинином необходимо для роста новых сосудов, питающих опухоль
Ученые из Японии исследовали механизм прикрепления внеклеточных везикул (ВВ), производимых опухолевыми клетками, к клеткам-мишеням. ВВ связываются с ламинином — компонентом внеклеточного матрикса. В этом процессе задействованы интегрины α6β4, α6β1 и ганглиозид GM1, причем интегрины работают без классической активации; прикрепление к ламинину облегчает белок CD151. Этот механизм критичен для ангиогенеза, что делает его перспективной целью для антиметастатической терапии.
J Cell Biol (2025) 224 (6): e202404064 | 10.1083/jcb.202404064 | CC BY 4.0
Клетки обладают собственной «почтовой системой» — они выпускают внеклеточные везикулы (ВВ), крошечные пузырьки с биологическим «сообщением», которые прикрепляются к другим клеткам и влияют на их поведение. При раке ВВ, в том числе их наиболее изученная группа — экзосомы (размер 40–200 нм), играют ключевую роль в формировании метастазов, перенося микроРНК, белки и метаболиты, которые перепрограммируют клетки-мишени и создают преметастатическую нишу — среду, подходящую для развития метастазов. Известно также, что ВВ могут служить биомаркерами или даже инструментами для доставки терапевтических агентов, но понимание их взаимодействия с клетками оставалось неполным.
Мембраны ВВ могут содержать интегрины — белки, которые в качестве клеточных рецепторов взаимодействуют с внеклеточным матриксом и передают внеклеточные сигналы. Хотя давно подозревали, что интегрины на поверхности ВВ участвуют в подготовке преметастатических ниш, прямых доказательств их связывания с элементами внеклеточного матрикса (ВКМ) у поверхности клеток-реципиентов до сих пор не было.
Группа японских исследователей решила детально изучить молекулярные механизмы, управляющие связыванием ВВ с поверхностью клеток. Чтобы выяснить, какие компоненты на поверхности везикул и на поверхности клеток-мишеней отвечают за это взаимодействие, они использовали передовые методы визуализации, включая отслеживание отдельных частиц и суперразрешающую микроскопию.
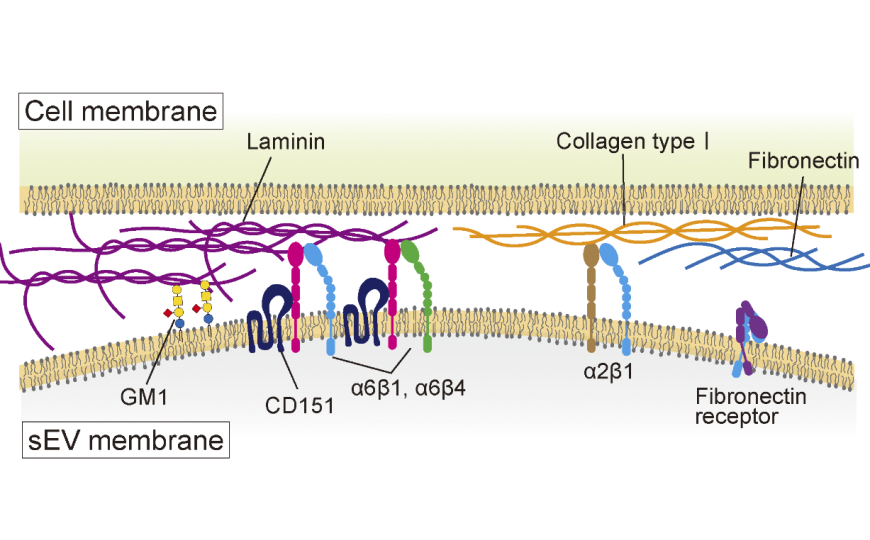
Ученые разработали экспериментальную систему для количественной оценки связывания ВВ различных типов — малых ВВ, среднеразмерных ВВ и микровезикул — с компонентами ВКМ, нанесенными на стеклянную подложку. Оказалось, что ВВ опухолевых клеток из четырех разных линий, независимо от размера, проявляли высокую аффинность к ламинину и почти не связывались с фибронектином.
Это стало неожиданностью: на поверхности везикул присутствовали рецепторы фибронектина (α5β1 и αVβ3), которые играют важную роль в самих опухолевых клетках, однако их активность была крайне низкой. Рецепторы ламинина на ВВ были гораздо активнее, что подтверждает ключевую роль ламинина в связывании опухолевых везикул и может объяснять их предпочтительную ориентацию, которая, в свою очередь, влияет на формирование метастазов.
Далее исследователи сосредоточились на поиске поверхностных молекул ВВ, которые обеспечивают их прикрепление к ламинину. Используя для продукции клетки рака простаты с CRISPR-Cas9-нокаутом интегринов, они выяснили, что интегриновые гетеродимеры α6β4 и α6β1 обеспечивают прикрепление малых ВВ к ламинину. Интегрин β1 оказался универсальным — он участвовал в связывании как с ламинином, так и с коллагеном I типа, тогда как α2β1 связывался только с коллагеном.
Кроме интегринов, важным игроком оказался ганглиозид GM1 — молекула, содержащая липидные и углеводные группы, концентрация которой в ВВ примерно в 30 раз выше, чем в родительских клетках. GM1 также связывался с ламинином (но не с фибронектином), тогда как другие ганглиозиды такой активности не проявляли. Липосомы с GM1 демонстрировали аналогичное связывание с ламинином, а удаление углеводной части GM1 на поверхности ВВ заметно снижало их адгезию. Это говорит о значительном вкладе GM1 в ламинин-зависимое связывание ВВ.
Одним из самых неожиданных результатов исследования стал механизм активации интегринов на поверхности ВВ. В клетках интегрины обычно активируются изнутри (через так называемую inside-out сигнализацию) с участием белков-триггеров, таких как талин 1 и киндлин 2. Однако эксперименты показали, что в ВВ эта схема не работает: нокаут или гиперэкспрессия талина 1 никак не влияли на связывание с ламинином, а киндлин 2 вовсе отсутствовал.
Подробный анализ подтвердил, что талин 1 в малых ВВ находится в нефосфорилированной (неактивной) форме — это исключает его участие в активации интегринов. Следовательно, связывание интегринов ВВ с ламинином происходит не через привычную клеточную активацию.
Здесь в игру вступает тетраспанин CD151, который, как выяснилось, облегчает прикрепление ВВ к ламинину. Любопытная деталь: холестерин, обильно присутствующий в мембранах ВВ, наоборот, мешает этому связыванию. Деплеция холестерина усиливала прикрепление везикул, а его добавление ослабляло эффект, причем зависимость от CD151 сохранялась. Холестерин не разрушал комплексы интегринов с CD151.
Наконец, суперразрешающая микроскопия показала: интегрины ВВ действительно связываются именно с ламинином на поверхности клеток-мишеней, что говорит о значительной важности этого механизма.
Чтобы выяснить функциональное значение обнаруженного механизма, исследователи проверили, как ВВ взаимодействуют с эндотелиальными клетками пупочной вены человека (HUVEC), ключевыми участниками ангиогенеза. Оказалось, что прикрепление ВВ к ламинину на поверхности HUVEC необходимо для стимуляции формирования клеточных выростов и ветвлений — критических этапов образования новых сосудов.
Примечательно, что сам ламинин в этом эксперименте не был обязателен для ветвления эндотелиальных клеток. Однако именно взаимодействие ВВ с ламинином запускало морфологические изменения, связанные с ангиогенезом.
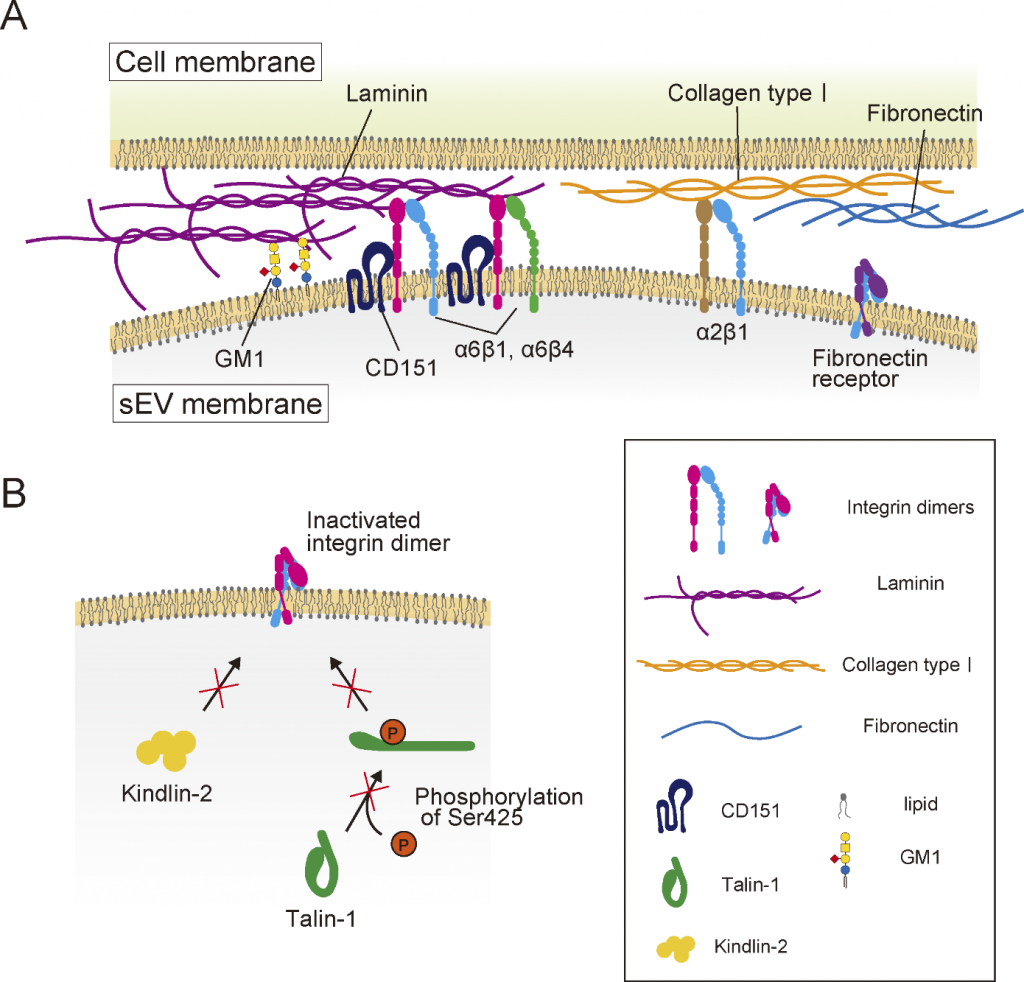 Связывание внеклеточных везикул (ВВ) с плазматической мембраной клетки-мишени. (A) Интегриновые гетеродимеры в составе ВВ — α6β1/α6β4 и α2β1 — могут связываться соответственно с ламинином и коллагеном I типа. CD151 усиливает связывание интегринов α6β1 и α6β4 в малых ВВ с ламинином. (B) Так как остаток Ser425 талина 1 во ВВ практически не фосфорилируется, он остается неактивным и не участвует в усилении связывания интегринов с компонентами матрикса, как и киндлин 2. DOI: J Cell Biol (2025) 224 (6): e202404064 |
10.1083/jcb.202404064 |
CC BY 4.0
Связывание внеклеточных везикул (ВВ) с плазматической мембраной клетки-мишени. (A) Интегриновые гетеродимеры в составе ВВ — α6β1/α6β4 и α2β1 — могут связываться соответственно с ламинином и коллагеном I типа. CD151 усиливает связывание интегринов α6β1 и α6β4 в малых ВВ с ламинином. (B) Так как остаток Ser425 талина 1 во ВВ практически не фосфорилируется, он остается неактивным и не участвует в усилении связывания интегринов с компонентами матрикса, как и киндлин 2. DOI: J Cell Biol (2025) 224 (6): e202404064 |
10.1083/jcb.202404064 |
CC BY 4.0
Таким образом, исследование японских авторов впервые подробно раскрывает, как опухолевые ВВ прикрепляются к внеклеточному матриксу клеток-мишеней, главным образом к ламинину. Этот процесс осуществляется через путь, в котором участвуют интегрины, ганглиозид GM1 и тетраспанин CD151, и не требует классической активации интегринов изнутри клетки (inside-out сигнализации). Он играет ключевую роль в стимуляции ангиогенеза, обеспечивая рост новых сосудов, необходимых для питания опухоли и ее распространения.
Поскольку формирование сосудов критично для метастазирования, выявленный механизм представляет интересную терапевтическую мишень. Блокирование взаимодействия опухолевых ВВ с ламинином может стать перспективным направлением в борьбе с прогрессирующими опухолями и их метастазами.
Внеклеточные везикулы от А до Я: какими бывают, как и зачем их получают и исследуют
Источник
Isogai, T., et al. Extracellular vesicles adhere to cells primarily by interactions of integrins and GM1 with laminin // Journal of Cell Biology. 224 (6), e2024040642 (2025), published online 30 April 2025. DOI: 10.1083/jcb.202404064


 Меню
Меню





 Все темы
Все темы




 0
0








