Внеклеточные везикулы от А до Я: какими бывают, как и зачем их получают и исследуют
Первого июня 2023 года состоялся вебинар «Внеклеточные везикулы: перспективные инструменты для диагностики и лечения заболеваний». Докладчики рассказали о разнообразии внеклеточных везикул — мембранных пузырьков, переносящих «послания» от клетки к клетке, — о том, какие методы используются для их изучения и с какими сложностями можно при этом столкнуться, а также представили слушателям новейшие данные и результаты собственных проектов в области выделения, характеристики и применения ВВ.
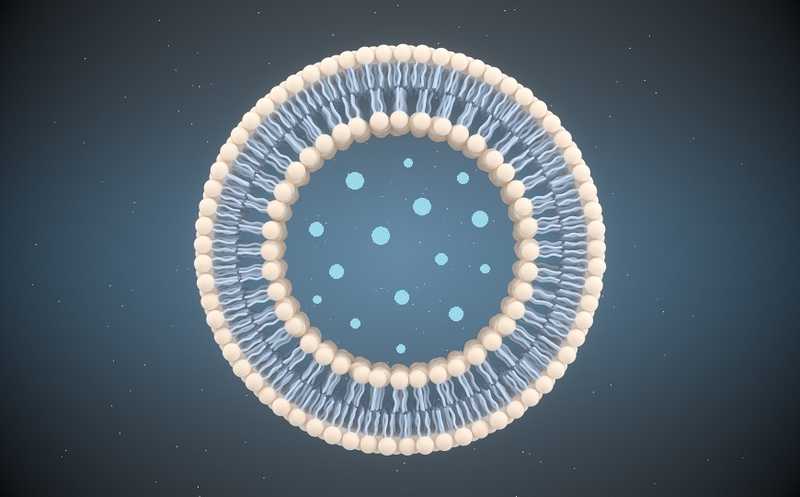
Внеклеточные везикулы (ВВ) — крошечные пузырьки, которые клетки тканей и органов выделяют в окружающую их среду. Они были обнаружены в различных жидкостях организма — крови, спинномозговой и амниотической жидкостях, слюне, сперме, лимфе и др. Во вступительной лекции модератор вебинара Денис Силачёв (Научный центр акушерства, гинекологии и перинатологии имени В.И.Кулакова, НИИ физико-химической биологии имени А.Н. Белозерского) рассказал о классификации ВВ, истории их открытия и дальнейших исследований, механизмах образования и захвата клеткой-реципиентом, биологическом значении и перспективах их применения для диагностики и терапии.
Внеклеточные везикулы образуются практически в любых клетках. Они участвуют в таких процессах, как клеточная миграция и метастазирование, апоптоз, метаболическое репрограммирование, регуляция иммунной системы, взаимодействие с микробиомом и другие. Их главная биологическая функция – передача информации от одной клетки к другой.
Впервые внеклеточные везикулы были описаны Питером Вульфом в 1967 году как «тромбоцитарный мусор» в плазме крови. Вульф отметил наличие на их поверхности фосфолипидов и фактора свертывания крови III и предположил, что они могут участвовать в свертывании крови. Примерно через 20 лет, в 1983–1985 годах, были описаны экзосомы. Согласно классификации 2023 года среди внутриклеточных везикул выделяют два больших типа: малые (20–200 нм) и большие (200 нм — 10 мкм). Мелкие супермеры и экзомеры (до 25 нм и до 50 нм) образуются в цитоплазме. Экзосомы (40–200 нм) представляют собой наиболее изученную группу внеклеточных везикул, образуются в цитоплазме и секретируются во внеклеточное пространство. Микровезикулы (100 нм — 1 мкм) формируются путем отпочковывания от цитоплазматической мембраны и занимают промежуточное положение по размерам. Более крупные апоптотические тельца могут содержать внутри себя органеллы. Наиболее крупным типом считаются связанные с раковыми клетками онкосомы (1–10 мкм). Отдельно рассматривают липидные капли (1–10 мкм), которые имеют однослойную (а не двухслойную) мембрану, но могут выделяться вместе с ВВ и снижать качество препарата. К относительно новым типам везикул относятся дефенсосомы, факторы защиты хозяина при инфекциях, например золотистым стафилококком или SARS-CoV-2, и миграсомы, являющиеся признаками мигрирующих клеток и имеющие структуру, похожую на гранат.
Далее докладчик рассмотрел механизмы образования микровезикул (эктосом) и экзосом. Эктосомы образуются на поверхности клеточной мембраны; за счет увеличения внутриклеточной концентрации кальция активируются Ca2+-зависимые ферменты (кальпаин, скрамблаза), при этом нарушается взаимодействие мембраны с цитоскелетом, происходит вздутие цитоплазмы и возникает пузырек, который затем отпочковывается. Экзосомы образуются внутри клетки из цитоплазматического содержимого; формируется ранняя эндосома, далее — мультивезикулярные тельца, которые мигрируют к мембране, сливаются с ней и высвобождают содержимое в межклеточное пространство. Экзосомы несут на своей поверхности большое количество белков тетраспанинов (CD63, CD9, CD81), чаще всего используемых в качестве их маркеров. В клетке имеются специальные механизмы сортинга полезного груза (белков, мРНК, миРНК) в экзосомы и эндосомы; груз зависит от типа клетки и ее физиологического состояния.
Денис Николаевич подчеркнул, что образование микровезикул — эволюционно древний и универсальный механизм коммуникации между клетками всех царств, кроме вирусов. С помощью ВВ обмениваться информацией могут не только клетки одного организма, но и представители разных царств. Это открывает возможности для разработки препаратов на основе микровезикул растений или бактерий: они могут сами по себе обладать терапевтическим действием или же выполнять функцию наноконтейнеров, доставляющих полезные грузы.
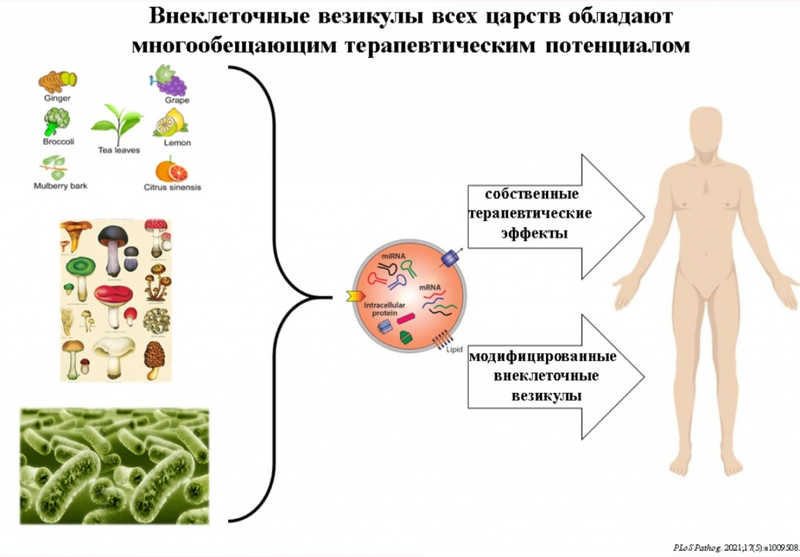
Далее докладчик перешел к практическим аспектам использования ВВ. Поскольку их состав отражает физиологическое состояние клеток и тканей, исследование ВВ может иметь диагностическую значимость. Жидкостная биопсия — отбор биологических жидкостей, в первую очередь крови, и анализ циркулирующих в них маркеров (опухолевые клетки, ДНК, внеклеточные везикулы) — минимально инвазивный, повторяемый способ исследования. В качестве примера Денис Николаевич привел исследование нейрональных экзосом как биомаркеров повреждений мозга. Из периферической крови были выделены внеклеточные везикулы, ассоциированные с нервной тканью, и проведен количественный анализ белков синаптоподина, синаптофизина, нейрональной енолазы, митохондриальной цитохром с-оксидазы. Эти маркеры могут свидетельствовать о развитии гипоксической ишемической энцефалопатии, что важно, например, в неонатологии, так как у новорожденных сложно диагностировать неврологические признаки нарушений.
И наконец, терапевтическое применение ВВ. Теоретически, если при патологическом состоянии ввести во внутреннюб среду организма «правильные» внеклеточные везикулы, то можно откорректировать течение патологии. В многочисленных исследованиях показано, что таким источником условно «здоровых» ВВ могут быть стволовые клетки, например, мультипотентные мезенхимальные стромальные клетки (ММСК). Открытие механизма терапевтического воздействия стволовых клеток с помощью ВВ вызвало смену парадигмы и сформировало новое направление в клеточных технологиях – бесклеточные (decellularized) препараты. Предполагается, что ВВ во многих случаях могут быть терапевтическим аналогом стволовых клеток.
Следующий докладчик, Василий Чернышёв (Научный центр акушерства, гинекологии и перинатологии имени В.И.Кулакова), говорил о выделении внеклеточных везикул из биологических жидкостей и их характеризации. Он подчеркнул, что выделение ВВ — весьма непростая задача, так как они сильно варьируют по размеру и плотности, пересекаясь по этим характеристикам с липопротеинами и вирусами. Работа занимает минимум три дня, обычно даже больше. Василий Сергеевич порекомендовал использовать для выделения ВВ пробирки для работы с белками, так как это позволяет минимизировать адсорбцию везикул, поверхность которых богата белками, к стенкам пробирки. Докладчик также отметил, что в моче и культуральной среде микровезикул на порядки меньше, чем в плазме крови, если работать с ними без предварительного концентрирования образца. Все это нужно учитывать при выборе метода выделения.
Существует много подходов к выделению везикул, и каждый год создаются новые методики; все они имеют свои преимущества и недостатки. Золотым стандартом считается дифференциальное центрифугирование. Также докладчик отметил такие подходы, как эксклюзионная хроматография, осаждение химическими веществами, например полиэтиленгликолем, иммунопреципитацию, ультрафильтрацию. В последнее время набирает популярность выделение ВВ с помощью микрофлюидных технологий.

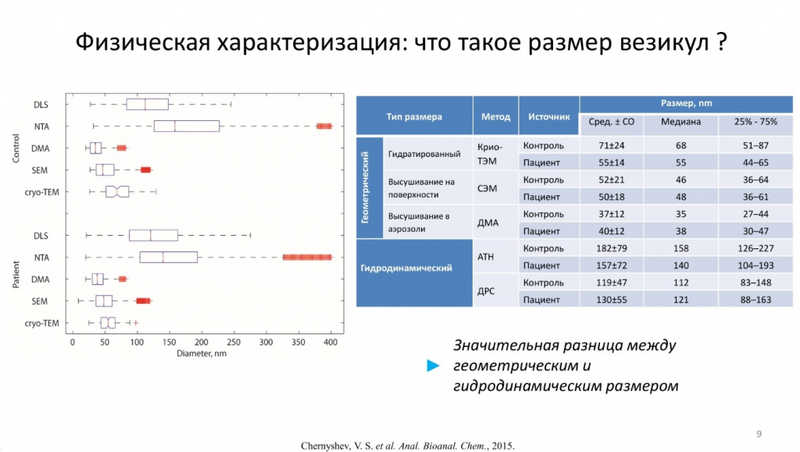
Затем докладчик рассказал о методах физической характеризации везикул. Он объяснил, что существует значительная разница между их геометрическим и гидродинамическим размером. Гидродинамический размер равен геометрическому только для идеально сферических гладких и твердых наночастиц, а биологические везикулы таковыми не являются из-за наличия у них мембраны, в состав которой входят белки, липиды, углеводы и другие молекулы; их эластичность сильно влияет на их подвижность. Определить геометрический размер везикул позволяют криотрансмиссионная электронная микроскопия (крио-ТЭМ), сканирующая электронная микроскопия (СЭМ) и дифференциальный анализ мобильности (ДМА). Крио-ТЭМ является золотым стандартом, однако подготовка образца и сам анализ достаточно сложны и длительны. Гидродинамический размер везикул позволяют определить анализ траектории наночастиц (АТН) и метод динамического рассеяния света (ДРС). АСМ-визуализация дает возможность проводить анализ везикул как в гидратированной, так и в высушенной форме, изучать трехмерную геометрию, определять их эластичность и присутствие на поверхности определенных маркеров.
Для молекулярной характеристики и исследования маркеров на поверхности везикул используют электронную микроскопию иммуномеченых мембранных белков, вестерн-блот, дот-блот, проточную цитометрию, рамановскую микроскопию и биослойную интерферометрию. Для анализа не только поверхности, но и внутреннего содержимого везикул широко применяют методы протеомики, липидомики и метаболомики.

В конце доклада Василий Сергеевич дал несколько методических советов по работе с внеклеточными везикулами. Во-первых, важно выбрать корректный метод их выделения. Во-вторых, для характеризации везикул полезно использовать комбинацию методов, так как работа проводится на наноуровне с достаточно сложными эластичными частицами. В-третьих, для каждого экспериментального этапа потребуется достаточно большой объем образца, и это нужно учитывать в самом начале работы: получать большой объем везикул и аликвотировать образцы, чтобы минимизировать влияние заморозки и разморозки. В качестве референса докладчик привел рекомендации по работе с внеклеточными везикулами MISEV 2018, обновление которых запланировано в ближайшее время.
Полина Вишнякова (Научный центр акушерства, гинекологии и перинатологии имени В.И.Кулакова) представила результаты первого этапа клинически ориентированного эксперимента по стимуляции роста эндометрия с помощью внеклеточных везикул in vitro. Полина Александровна и ее коллеги работали с эндосомами от мезенхимальных стромальных клеток (МСК) пупочного канатика. МСК — удобный и перспективный источник ВВ; на сайте clinicaltrials.gov, где регистрируются все клинические испытания, сейчас можно обнаружить 16 зарегистрированных исследований, где экзосомы от МСК использованы для лечения заболеваний, в основном респираторных, а также синдрома сухого глаза и острого ишемического инсульта. Внутри таких экзосом содержатся разнообразные белковые проангиогенные и пропролифераторные факторы, которые стимулируют рост клеток, воздействуя на их рецепторы.
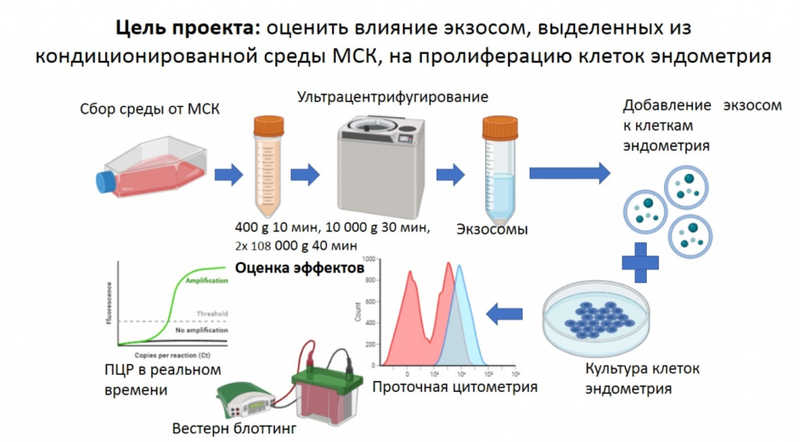
Целью проекта, представленного Полиной Вишняковой, была оценка влияния экзосом, выделенных из кондиционированной среды МСК, на пролиферацию клеток эндометрия. Экзосомы выделяли методом ультрацентрифугирования, затем аликвотировали, замораживали, характеризовали и добавляли к культуре клеток эндометрия. Эффекты оценивали с помощью проточной цитометрии, вестерн-блоттинга и ПЦР в реальном времени.
Почему были использованы именно клетки эндометрия? Внутриматочные вмешательства способствуют нарушению нормальной структуры эндометрия; при этом может образоваться повышенное количество фиброзной ткан или внутриматочные синехии, что приводит к синдрому Ашермана (облитерации матки спайками) или формированию «тонкого» эндометрия. Это, в свою очередь, может вызвать бесплодие, поскольку эмбрион не сможет имплантироваться и закрепиться в полости матки.
Полина Александровна вместе с коллегами получали биопсийный материал эндометрия в результате гистероскопии по трубному фактору бесплодия. Клетки выделяли и культивировали по стандартному и хорошо отработанному протоколу. Фенотипическое профилирование культуры проводили с помощью проточной цитометрии. В культуре присутствовали клетки эпителия (EpCAM+), эндотелия (CD146+), МСК (CD90+, Vimentin+, CD146+), лейкоциты (CD45+), гемопоэтический клетки (CD34+). Экзосомы типировали методом вестерн-блоттинга на характерные для них тетраспанины CD9 и CD81.
Далее исследователи подобрали оптимальную концентрацию экзосом, которую нужно добавить к клеткам эндометрия, с помощью МТТ-анализа, импеданс-анализа, оценки процента активно пролиферирующих Ki-67+ клеток методом проточной цитометрии и продукции основных циклинов методом вестерн-блоттинга. Они установили, что экзосомы, полученные из кондиционированной среды МСК, в концентрации 50 нг/мкл активируют пролиферацию первичной культуры эндометрия, что сопровождается повышением Ki-67+ клеток, экспрессии циклинов А1, Е2 и активным вступлением в митоз.
Полина Александровна поделилась планами дальнейшей работы, которые включают исследования in vivo и экспериментальное лечение бесплодия, вызванного «тонким» эндометрием и синдромом Ашермана. Уже разработана модель синдрома Ашермана на крысе. Далее планируются эксперименты по введению внутрь матки экзосом от МСК крысы, инкорпорированных в гелевый PRP-скаффолд, что обеспечит их контролируемое высвобождение.
Доклад Егора Плотникова (НИИ физико-химической биологии имени А.Н. Белозерского, МГУ имени М.В. Ломоносова) был посвящен применению внеклеточных везикул для лечения острых ишемических патологий почек. ВВ вырабатываются различными типами клеток в разных отделах нефрона. Они охарактеризованы по специфическим маркерам, которые отличаются для разных клеток-продуцентов. Егор Юрьевич и его коллеги изучали in vitro, с одной стороны, как изменяется продукция ВВ клеток почки крысы при моделировании ишемии, а с другой стороны, как изменяются биологические эффекты везикул в зависимости от того, продуцируют ли их интактные клетки почки или клетки при повреждении. Они выделяли клетки эпителия почечных канальцев, культивировали, затем часть культур подвергали моделированию ишемии (кислородно-глюкозной депривации), а часть оставляли интактными в качестве контроля. Затем собирали из культуральной среды везикулы и характеризовали их по маркерам CD9, CD81, TSG101, таким образом подтверждая, что это экзосомы.
С помощью АТН исследователи получили спектр распределения концентрации и размера везикул. В контрольных образцах большая часть ВВ имела размеры 100–200 нм; везикулы такого размера принято относить к экзосомам. При ишемии возникало два изменения: резко уменьшалось количество везикул, продуцируемых клетками, и менялся спектр их размеров — происходил сдвиг в сторону более крупных везикул. Это может быть связано с тем, что после повреждения возрастает доля апоптотических телец.
Далее исследователи проанализировали биологические эффекты везикул. Они вырастили новые клеточные культуры почки, к ним добавляли ВВ, полученные в предыдущей серии экспериментов от поврежденных и интактных клеток. У части культур вызывали ишемию, часть оставляли интактными и проводили МТТ-тест, который говорит о пролиферации или гибели клеток. Исследователи зафиксировали влияние ВВ на жизнеспособность интактных клеток: при добавлении везикул от клеток после ишемии происходило значимое усиление пролиферации. Для поврежденных клеток не показано статистически значимых эффектов. Егор Юрьевич связывает такой неожиданный результат с эффектом прекондиционирования: поврежденные клетки «сообщают» соседним клеткам о необходимости готовиться к повреждению, и это повышает их толерантность к будущему стрессу.
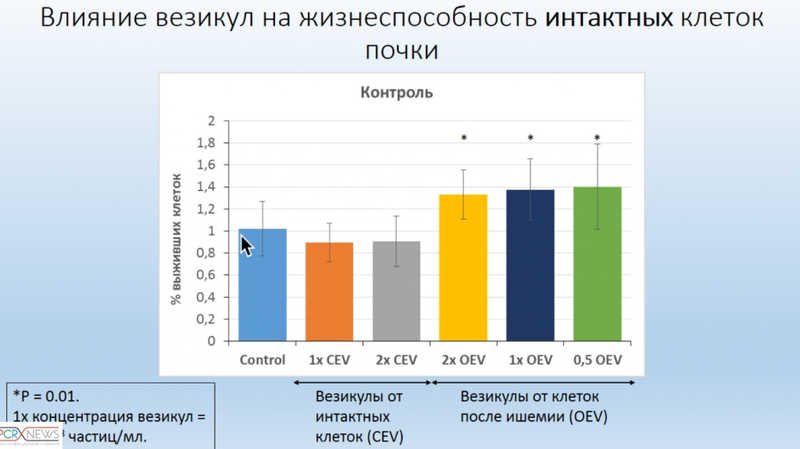
Исследователи также изучили влияние везикул, выделяемых ММСК, на клетки канальцевого эпителия почки. Везикулы ММСК увеличивали скорость пролиферации клеток почки после повреждения, вызванного кислородно-глюкозной депривацией, и не влияли на нее до повреждения. Эти результаты являются основой для анализа механизмов действия ВВ, в частности, уже начато профилирование микроРНК, а в дальнейшем предполагается изучение протеома.
В заключение Надежда Гробер (ООО «Альгимед») поделилась информацией о доступных коммерческих решениях для анализа микроРНК методом ОТ-ПЦР и использования проточной цитометрии при работе с экзосомами.
Для клеток разных тканей характерны специфические профили экспрессии микроРНК (300–400 «мажорных» молекул). Неопластическая трансформация сопровождается изменениями профиля внутриклеточных микроРНК, а развитие злокачественной опухоли изменяет профиль циркулирующих микроРНК. Поэтому микроРНК биопсийного материала и плазмы — перспективные диагностические маркеры. Прежде всего они находят применение при работе с опухолевыми клетками, но могут быть использованы в диагностике нейродегенеративных процессов, и в целом спектр применения микроРНК очень широк.
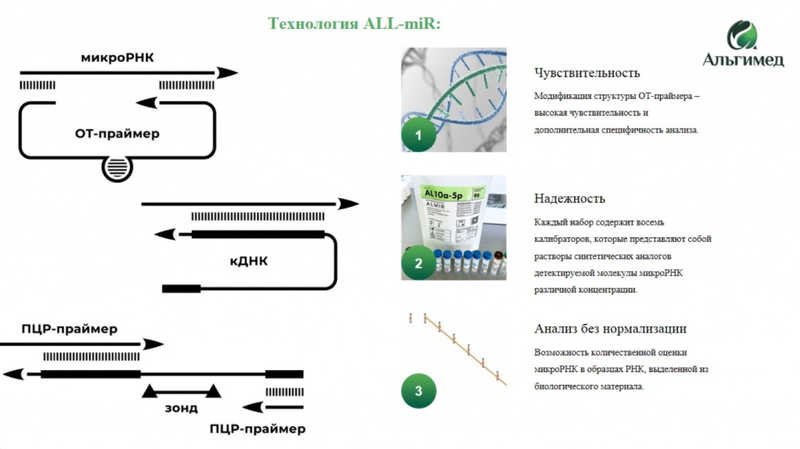
Сложность работы с микроРНК состоит в том, что эти молекулы короткие, а для высокой специфичности реакции необходимо посадить на них более одного праймера. В 2005 году был разработан метод обратной транскрипции с помощью праймера, формирующего петлю (stem-loop primer). Такой подход позволил получать кДНК длиной 50-60 п.н., которую можно использовать в качестве матрицы для ПЦР.
Научно производственная компания «Альгимед Техно» предлагает собственную разработку — систему ALMIR-microRNA, которая основана на описанном подходе, но имеет ряд модификаций, определяющих ее высокую чувствительность, специфичность и удобство применения для рутинных операций. Специфичность обеспечивается двумя сайтами взаимодействия ОТ-праймера и микроРНК. Чувствительность обусловлена системой детекции амплификации с помощью Flu-labelled миРНК-специфичного зонда. В сравнении с другими методами детекция микроРНК системой ALMIR происходит на 2–4 цикла раньше. Еще одна особенность набора — возможность количественного анализа без нормализации за счет линейки калибраторов, то есть синтетических микроРНК известной концентрации. Надежда Александровна отметила, что есть возможность собрать такой набор под заказ, если необходимой исследователям молекулы нет в каталоге на сайте.
Вторая часть доклада Надежды Гробер была посвящена возможностям использования проточной цитометрии при работе с экзосомами. Наборы Exo-FACS позволяют провести изоляцию экзосом из биологических жидкостей и культуральных сред, анализ их маркеров при помощи проточной цитометрии и анализ их полного профиля. Набор состоит из реагентов для химического осаждения, латексных частиц и антител. Захват экзосом происходит с помощью иммуногранул с их последующим осаждением и элюированием.
В качестве примера использования проточной цитометрии Надежда Александровна привела исследование, в котором экзосомы выделили из культуральной среды клеток колоректального рака методом дифференциального центрифугирования. Они были охарактеризованы с помощью анализа траектории наночастиц, а далее был проведен анализ мБТШ70+ везикул из тотальной популяции с помощью проточной цитометрии.
В конце доклада Надежда Гробер рассказала о проточном цитометре CytoFocus 421 (Healicom, Китай) с двумя лазерами и восемью каналами. Данный прибор предлагается к использованию как демонстрационный, его протестируют для работы с экзосомами; есть возможность проведения на нем испытаний с образцами.
Информация о докладчиках
МОДЕРАТОР: Силачёв Денис Николаевич, д.б.н., заведующий лабораторией клеточных технологий ФГБУ «НМИЦ АГП им. В.И.Кулакова» Минздрава России; заведующий лабораторией биохимии двигательных систем НИИ физико-химической биологии имени А.Н. Белозерского (Москва)
Чернышёв Василий Сергеевич, к.т.н., руководитель лаборатории биофотоники ФГБУ «НМИЦ АГП им.В.И.Кулакова» Минздрава России (Москва)
Вишнякова Полина Александровна, к.б.н., заведующая лабораторией регенеративной медицины ФГБУ «НМИЦ АГП им. В.И.Кулакова» Минздрава России, доцент кафедры гистологии, цитологии и эмбриологии РУДН (Москва)
Плотников Егор Юрьевич, д.б.н., профессор РАН, заведующий лабораторией структуры и функции митохондрийа отдела функциональной биохимии биополимеров НИИ физико-химической биологии имени А.Н.Белозерского, МГУ имени М.В. Ломоносова (Москва)
Гробер Надежда Александровна, руководитель отдела клеточной и молекулярной биологии ООО «Альгимед» (Москва)


 Меню
Меню





 Все темы
Все темы




 0
0








