TIMP2 регулирует нейропластичность гиппокампа, влияя на внеклеточный матрикс
Один из факторов, способных омолаживать мозг на фенотипическом уровне — это тканевый ингибитор металлопротеиназ 2 (TIMP2). Ученые из Медицинского центра Маунт-Синай провели опыты на мышиной модели и показали, что этот белок регулирует функцию гиппокампа, контролируя нейрогенез у взрослых животных и влияя на синаптическую пластичность — при нокауте TIMP2 внеклеточный матрикс в гиппокампе становился слишком плотным, а у мышей нарушалась пространственная память и распознавание контекста.
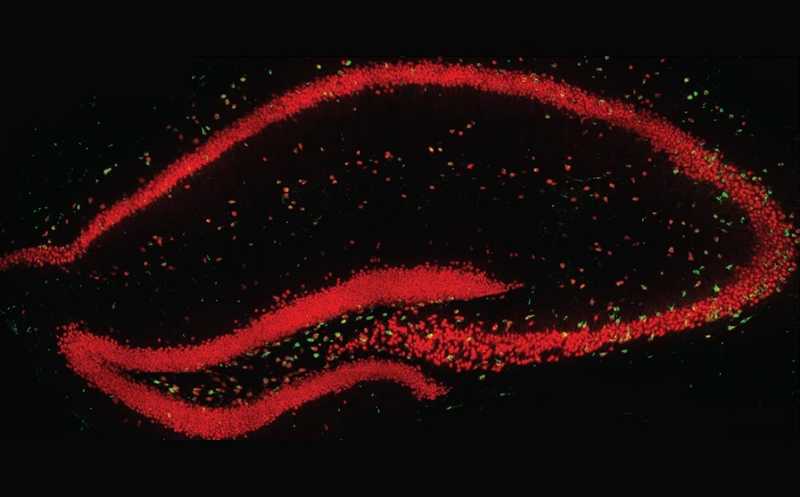
Срез гиппокампа мыши (красным окрашен NeuN — маркер нейронов, зеленым — TIMP2).
Credit:
Molecular Psychiatry (2023). DOI:
10.1038/s41380-023-02296-5 |
CC BY
Полученные на мышиных моделях данные указывают на то, что мозг можно омолаживать путем системного воздействия, например, при помощи переливания молодой плазмы или гетерохронного парабиоза — хирургического соединения кровообращения молодой и старой мыши, которое обеспечит доступ молодой крови к мозгу старой мыши. В молодой крови выявлены факторы, которые обеспечивают фенотипическое омоложение мозга у старых мышей. Среди них — тканевый ингибитор металлопротеиназ 2 (tissue inhibitor of metalloproteinases-2, TIMP2). Уровень этого секретируемого белка повышен в раннем возрасте; также известно, что он способен восстанавливать функцию гиппокампа у пожилых мышей. TIMP2 известен своей способностью к ремоделированию периферического внеклеточного матрикса. С одной стороны, он регулирует переход матриксных металлопротеиназ (matrix metalloproteinase, MMP), включая MMP2, в протеолитически активные формы, а с другой стороны, ингибирует их активность. Поскольку уровни TIMP2 в гиппокампе снижаются с возрастом, понимание его функции важно для использования в терапии возрастных заболеваний головного мозга. Однако о клеточных и молекулярных деталях, связывающих TIMP2 с функцией гиппокампа, известно мало.
Команда ученых из Школы медицины Икана Медицинского центра Маунт-Синай определила механизм, с помощью которого TIMP2 регулирует компоненты внеклеточного матрикса в гиппокампе, воздействуя на процессы, связанные с пластичностью и памятью. Результаты исследования они опубликовали в журнале Molecular Psychiatry.
При помощи иммуногистохимии и конфокальной микроскопии исследователи обнаружили, что TIMP2 преимущественно экспрессируется в воротах зубчатой извилины (dentate gyrus, DG), а также в областях гиппокампа CA3 и CA1. Большинство клеток, экспрессирующих TIMP2, также окрашивались на общенейрональный маркер (ядерный белок NeuN). Таким образом, основным клеточным источником экспрессии TIMP2 в этих областях были нейроны. Также ученые обнаружили высокие уровни TIMP2 во внеклеточном пространстве мозга.
Далее ученые выделили гиппокамп от мышей дикого типа (WT) и нокаутных по гену TIMP2 (TIMP2 KO) и провели секвенирование РНК. Они обнаружили у TIMP2 KO в общей сложности 905 дифференциально экспрессируемых генов по сравнению с WT. Экспрессия 449 из них в гиппокампе нокаутных мышей была подавлена. По этим данным ученые провели анализ обогащения набора генов ( GSEA). Оказалось, что гены со сниженной экспрессией у TIMP2 KO были связаны с такими биологическими процессами, как клеточный морфогенез, нейрогенез и организация синапсов, в то время как повышение экспрессии затрагивало гены, связанные с гибелью клеток.
Чтобы проверить, влияет ли TIMP2 на нейрогенез, исследователи оценили уровень пролиферации клеток в гиппокампе. Они ввели мышам бромдезоксиуридин (BrdU) — маркер пролиферирующих клеток — чтобы пометить такие клетки в зубчатой извилине. Выяснилось, что у мышей TIMP2 KO значительно меньше пролиферирующих клеток, чем у мышей дикого типа — это количественно определялось по общему количеству BrdU-положительных клеток. Авторы также продемонстрировали, что потеря TIMP2 снижает количество дендритных шипиков в гранулярных клетках зубчатой извилины. Дальнейшие опыты показали, что это приводит к нарушению памяти в различных задачах, зависящих от гиппокампа. Так, мыши, нокаутные по TIMP2, хуже справлялись с задачами на пространственную память. Кроме того, у них нарушалось распознавание контекста, связанное с функциями гиппокампа — на это указали результаты опытов с условно-рефлекторным замиранием.
Также ученые оценили уровни про-MMP2 в лизатах гиппокампа мышей и в отсутствие TIMP2 обнаружили значительное повышение MMP2 как на уровне гена, так и белка. Это указывает на потенциальное нарушение метаболизма внеклеточного матрикса в гиппокампе. Кроме того, в молекулярном слое зубчатой извилины у мышей TIMP2 KO была значительно увеличена плотность точек аггрекана — основного хондроитинсульфатпротеогликана внеклеточного матрикса, связанного с синаптической пластичностью и памятью. Скопления аггрекана при этом обнаруживались в точках синаптической плотности, чего не наблюдалось у мышей дикого типа. Отсутствие TIMP2 также приводило к более плотной структуре внеклеточного матрикса, которая ограничивала миграцию незрелых нейробластов внутри зубчатой извилины.
Таким образом, TIMP2 через ремоделирование внеклеточного матрикса влияет на пластичность гиппокампа, регулируя нейрогенез во взрослом мозге и синаптическую пластичность. По словам доктора Джозефа Кастеллано, профессора кафедры нейробиологии и неврологии и старшего автора работы, «изучение путей, регулирующих внеклеточный матрикс, может иметь важное значение для разработки новых методов лечения заболеваний, при которых нарушается пластичность».
Цитата по пресс-релизу
Белок из крови тренированных мышей «омолодил» мозг неактивных животных
Источник
Ferreira, A.C., et al. Neuronal TIMP2 regulates hippocampus-dependent plasticity and extracellular matrix complexity. // Mol Psychiatry (2023). DOI: 10.1038/s41380-023-02296-5


 Меню
Меню





 Все темы
Все темы




 0
0








