У малярийного плазмодия найден новый ген устойчивости к хлорохину
Анализ геномов малярийного плазмодия Plasmodium falciparum обнаружил новый ген, ассоциированный с устойчивостью к хлорохину, — ген транспортера аминокислот pfaat1. В нем выявили два значимых однонуклеотидных полиморфизма: один существенно повышает устойчивость паразита к препарату, но снижает общую приспособленность, другой несколько снижает устойчивость к хлорохину, но повышает приспособленность, вероятно, компенсируя неблагоприятный эффект первого полиморфизма.
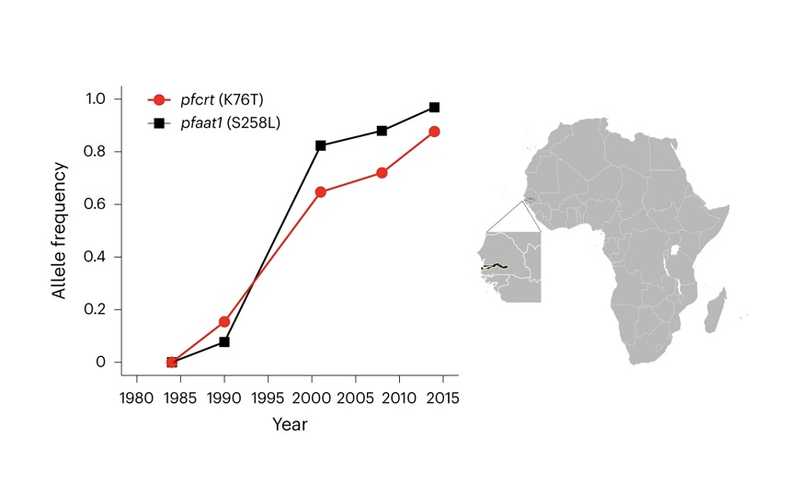
Анализ 600 геномов плазмодия из Гамбии показывает быстрый рост частоты мутаций, ассоциированных с устойчивостью к хлорохину, в последние 30 лет.
Credit:
Nature Microbiology 2023. DOI: 10.1038/s41564-023-01377-z
Устойчивость к лекарствам — серьезное препятствие на пути к контролю инфекций, не только бактериальных или вирусных, но и протозойных. Так, малярийный плазмодий Plasmodium falciparum, устойчивый к наиболее распространенному препарату для профилактики и лечения малярии, хлорохину, стал причиной неудачи проекта по искоренению этого заболевания в XX веке. Авторы статьи в Nature Microbiology описали новый ген плазмодия, ассоциированный с устойчивостью.
Хлорохин убивает паразитов за счет нарушения процессов переваривания гемоглобина; при этом внутри клетке плазмодия накапливаются токсичные для него молекулы гемы — промежуточные продукты разложения гемоглобина. В результате активных исследований устойчивости плазмодиев к хлорохину был идентифицирован ассоциированный с ней ген pfcrt на хромосоме 7, кодирующий один из мембранных насосов. Паразиты, несущие мутантный аллель pfcrt K76T (здесь и далее подчеркнуты мутантные аллели), способны к значительно более быстрому удалению хлорохина из пищеварительных вакуолей, что и обеспечивает устойчивость к препарату.
Чтобы оценить вклад других генов плазмодия в эволюцию устойчивости к хлорохину, ученые проанализировали 600 геномов P. falciparum из образцов, отобранных между 1984 и 2014 гг. Всего было идентифицировано 16385 однонуклеотидных полиморфизмов (SNP). Далее на основе динамики частоты встречаемости аллелей идентифицировались гены, подверженные отбору. Так, частота аллеля pfcrt K76T выросла с 0% в 1984 году до 88% в 2014г. Сходный рост частоты (с 0 до 97% за тот же период) наблюдался для мутантного аллеля S258L другого гена —pfaat1, который находится на хромосоме 6 и кодирует транспортер аминокислот
Если считать, что поколение сменяется за 6 месяцев, то коэффициент отбора составляет 0,18 для pfaat1 S258L и 0,11 для pfcrt K76T. Присутствие сильного давления отбора на эти два гена подтвердилось и высокой степенью идентичности по происхождению несущих их участков генома, особенно по сравнению с остальным геномом. Также наблюдалось неравновесие по сцеплению между pfcrt и pfaat1, что в случае генов, находящихся на разных хромосомах, указывает на функциональную связь.
Анализ гаплотипической структуры pfaat1 выявил интересную особенность эволюции — аллель S258L имеет высокую частоту (58%) в Юго-Восточной Азии (ЮВА), однако на этой территории они находятся на других ветвях сети, чем тот же аллель в Гамбии и других регионах Африки. Это предполагает независимую эволюцию S258L в Африке и ЮВА, в отличие от pfcrt вариантов, которые попали в Африку из Азии. Также был идентифицирован ещё один аллель pfaat1, F313S, распространившийся в ЮВА почти до уровня фиксации.
В следующем эксперименте ученые использовали мышей, которым были пересажены человеческие гепатоциты. Такой метод позволяет получать гибридные линии малярийного плазмодия в лабораторных условиях. Авторы скрещивали линию паразита дикого типа 3D7 с устойчивой к хлорохину линией NHP4026. Далее потомство обрабатывали хлорохином или нейтральным контролем и оценивали частоту аллелей в полученных выборках. Анализ выявил два локуса количественных признаков (QTL) — один на хромосоме 7, несущий ген pfcrt; второй на 6 хромосоме, несущий ген pfaat1.
Наконец, исследователи использовали систему CRISPR-Cas9 для более детального изучения влияния pfaat1 мутаций на устойчивость. Искусственно были получены плазмодии, несущие мутантный аллель pfcrt K76T и аллель дикого типа в одном или обоих локусах в гене pfaat1. Опыты показали, что аллель S258L повышает устойчивость к хлорохину в полтора раза. При этом в комбинации с F313S этот эффект снижался, хотя и оставался статистически значимым.
Авторы предположили, что подобные результаты связаны с балансом между устойчивостью к лекарству и приспособленностью паразита в отсутствии хлорохина. Действительно, плазмодии, несущие генотип pfcrt K76T и pfaat1 S258L/F313F, обладали наименьшей приспособленностью в среде без хлорохина. Генотипы S258L/F313S и S258S/F313S обладали схожей приспособленностью, а паразиты, имеющие аллели дикого типа в обоих локусах pfaat1 оказались наиболее конкурентноспособными.
Таким образом, исследователи показали ассоциацию гена pfaat1 с устойчивостью малярийного плазмодия к хлорохину, а также описали эффект двух однонуклеотидных мутаций в данном гене. В то время как pfaat1 S258L повышает устойчивость ценой пониженной общей приспособленности, pfaat1 F313S снижает устойчивость к терапии, но повышает общую приспособленность, предположительно выполняя компенсаторную роль.
Источник
Amambua-Ngwa, A., et al. Chloroquine resistance evolution in Plasmodium falciparum is mediated by the putative amino acid transporter AAT1 // Nature Microbiology 2023. DOI: 10.1038/s41564-023-01377-z


 Меню
Меню





 Все темы
Все темы




 0
0








