Грипп и ОРВИ в сезоне 2023-2024 гг.: комментируют специалисты
В России доля инфицированных SARS-CoV-2 среди тяжелых больных в прошедшем эпидсезоне была около 5% — в три раза меньше, чем инфицированных гриппом. Минздрав РФ готовит к выходу обновленную редакцию клинических рекомендации по ведению больных с ОРВИ. Какие преимущества имеет универсальная противогриппозная вакцина для интраназального введения перед инъекционной, что представляет собой синдромный подход в молекулярной диагностике респираторных заболеваний и многие другие вопросы — на вебинаре PCR.NEWS.
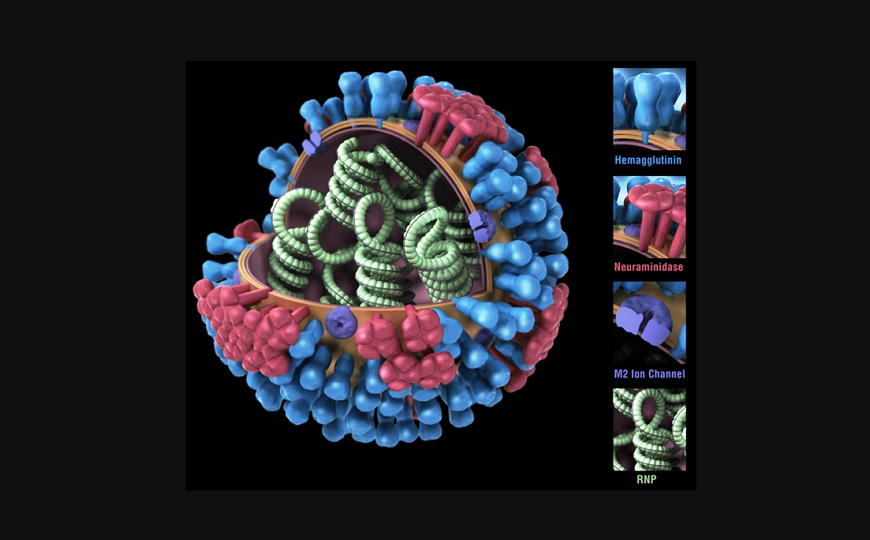
Вирус гриппа
Credit:
CDC
Первого ноября на платформе PCR.NEWS прошел вебинар «Грипп и ОРВИ в сезоне 2023-2024 гг. Эпидемиология, особенности диагностики и терапии». Ведущие специалисты обсудили эпидемиологическую ситуацию в прошедшем и текущем сезонах, подходы к терапии и диагностике респираторных заболеваний у взрослых и детей.
Во вступительном слове модератор мероприятия, заместитель директора по научной работе НИИ гриппа Дарьи Даниленко отметила, что новый эпидсезон респираторных заболеваний уже начался. Дарья Михайловна представила доклад, посвященный эпидемиологической ситуации по гриппу и ОРВИ в мире и в России.
В предыдущем эпидсезоне (2022–2023 гг.) в северном полушарии активно циркулировали вирусы гриппа — на уровне, сопоставимом с периодом до пандемии COVID-19. В основном циркулируют вирусы гриппа A линий H1 и H3 и вирус гриппа B линии Victoria. Другие линии вируса гриппа B (Yamagata) со времени пандемии в циркуляцию не вернулись. При этом вирусы гриппа A значительно преобладают над вирусами гриппа B. Дарья Михайловна также отметила, что в последнем сезоне частота заболеваемости гриппом превышала таковую для SARS-CoV-2, что свидетельствует о приобретении последним сезонного характера.
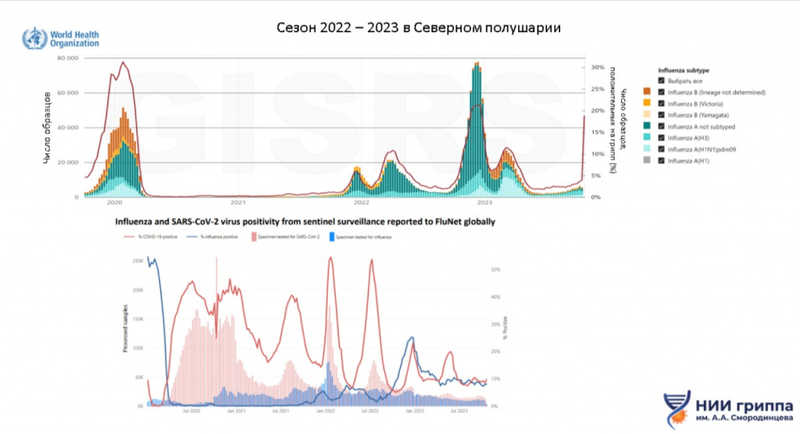
В Европейском регионе ВОЗ в прошедшем сезоне грипп вносил основной вклад как в число амбулаторных больных, так и в частоту госпитализаций. Респираторно-синцитиальный вирус (РСВ) внес больший вклад в число госпитализаций, чем в число амбулаторных больных. Активность SARS-CoV-2 на протяжении всего сезона была невелика и достаточно стабильна. Среди различных типов гриппа в начале эпидемиологического периода доминировал подтип H3N2, который затем сменился вирусом гриппа B. Такие паттерны являются привычными для эпидемиологов и соответствуют допандемийной картине. В большинстве стран региона наблюдалась умеренная, но продолжительная эпидемия, при этом резко сократилась доля тяжелых больных с диагнозом COVID-19.
В Американском регионе ВОЗ наблюдалась сходная картина, однако доля гриппа B была незначительной. При этом частота смертей от гриппа среди детей выросла до уровня, наблюдавшегося до пандемии COVID-19.
В России в прошлом сезоне была продолжительная эпидемия гриппа с высокой интенсивностью и ранним началом — уже на 45-й неделе уровень заболеваемости превысил базовый на 35%. В отличие от Европы и США основной вклад в эпидемию внес подтип гриппа A(H1N1)Pdm09, который далее сменился гриппом B; это способствовало высокой продолжительности эпидемии (26 недель). Доля SARS-CoV-2 в прошедшем сезоне среди тяжелых больных была около 5%, тогда как у гриппа около 16%.
Дарья Михайловна также привела данные по возбудителям тяжелых респираторных инфекций (ТОРИ) по возрастам. Вклад гриппа наблюдался во всех возрастных группах, с большим влиянием среди школьников и лиц старше 18 лиц. Среди детских групп был более существенным вклад ОРВИ (в частности, РСВ), а в группах старше 60 лет все еще выражен вклад SARS-CoV-2.
В южном полушарии наблюдается активная циркуляция вирусов A и B (с доминированием линии H1), а также РСВ.
Затем Дарья Михайловна перешла к текущей эпидемиологической ситуации. В настоящее время растет активность гриппа, в частности, линии H3. В Европе и Северной Америке ситуация по гриппу на данный момент стабильная. В Японии наблюдается крайне высокий рост заболеваемости гриппом, в особенности гриппом A линий H3 и H1, при этом активность вируса сохранялась как в летние, так и в осенние месяцы.
Частота заболеваемости SARS-CoV-2 в мире, по данным ВОЗ, за последний месяц снизилась на 42%. Незначительный рост заболеваемости отмечен в Европе и Юго-Восточной Азии. Стабильной остается ситуация по РСВ с небольшим подъемом заболеваемости только в США.
В России эпидситуация также стабильна. На неделе, предшествующей вебинару (23–29 октября), даже наблюдалось снижение суммарной заболеваемости гриппом и другими респираторными заболеваниями — 68,4 случая на 10000 населения, что ниже базовой линии. При этом диагностируется большое число случаев ОРВИ (16% положительных образцов), среди которых преобладает риновирусная инфекция. Также наблюдается небольшой рост заболеваемости SARS-CoV-2, в то время как частота заболеваемости гриппом и РСВ стабильно низкая (0,1 и 0,2%).
В завершение доклада Дарья Михайловна напомнила, что вебинар приурочен ко Всемирному дню гриппа и что приоритетной мерой профилактики остается ежегодная вакцинация. В этом году был в очередной раз обновлен компонент вакцин против линии H1N1, так как предыдущие вакцины уже не эффективны против циркулирующих штаммов.
Данные по эпидемиологической ситуации в России и в мире еженедельно обновляются на сайте НИИ гриппа им. А.А. Смородинцева.
Второй доклад вебинара «Лечение ОРВИ у взрослых» представил директор НИИ гриппа Дмитрий Лиознов. Во время пандемии COVID-19 проблемой стали наложение волн заболеваемости различными типами респираторных инфекций и затруднение дифференциальной диагностики по симптомам заболеваний. Симптоматика сходная, рентгеновская и КТ диагностика также не позволяют в большинстве случаев разделить SARS-CoV-2, грипп и ОРВИ при развитии пневмонии. Не работает и оценка уровня провоспалительных цитокинов. Лабораторная верификация диагноза требует времени и может быть недоступна для медицинского учреждения, особенно за пределами Москвы и Санкт-Петербурга. Это затрудняет выбор терапии, так как алгоритмы лечения респираторных инфекций различаются. Осложняет ситуацию и позднее обращение пациентов за помощью, например, в случаях самолечения.
Перед системой здравоохранения стоят задачи предупреждения развития тяжелых и осложненных форм заболевания, сокращения сроков распространения вируса, воздействия непосредственно на возбудитель (а не только купирования симптомов) и обеспечения максимальной безопасности терапии.
Дмитрий Анатольевич перечислил группы риска по развитию осложнений гриппа и ОРВИ: это прежде всего лица старшего возраста, пациенты с хроническими заболеваниями, маленькие дети и беременные женщины. Для групп риска в первую очередь рекомендуется вакцинация против гриппа и SARS-CoV-2. Однако осложнения могут возникнуть у любого пациента.

Докладчик привел данные исследований, которые показали прямую связь тяжести симптомов гриппа и РСВ с вирусной нагрузкой. Таким образом, снижение вирусной нагрузки способствует купированию симптомов.

Дмитрий Лиознов напомнил, что терапия инфекционных заболеваний стоит на «трех китах» — симптоматической терапии, патогенетической терапии и этиотропной терапии (воздействию на возбудитель). Последнюю можно разделить на специфическую терапию (лечебные сыворотки иммуноглобулины и проч.) и неспецифическую.
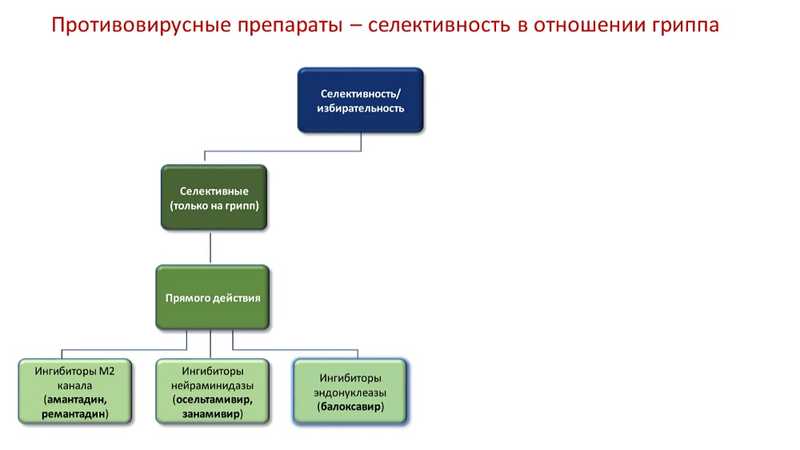
Среди противовирусных препаратов, в свою очередь, различают селективные и неселективные в отношении гриппа. К селективным препаратам прямого действия относятся ингибиторы М2 канала (амантадин, ремантадин; в настоящее время неэффективны и не применяются), ингибиторы нейраминидазы (осельтамивир, занамивир) и ингибиторы эндонуклеазы (балоксавир). Последний является наиболее новым типом препарата, однако есть сложности с его поставками.
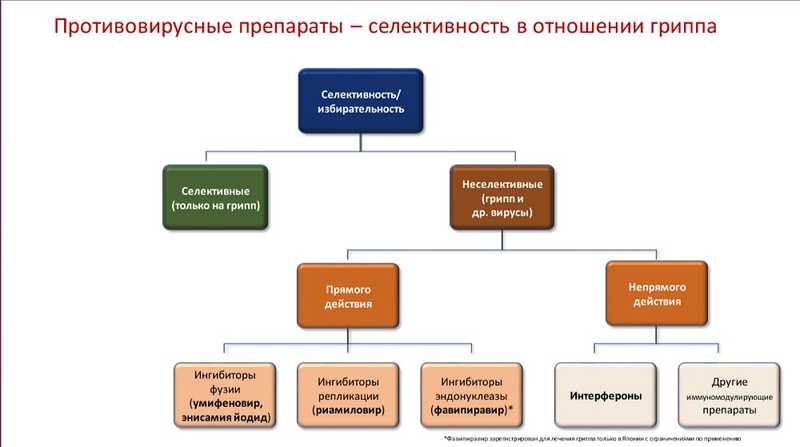
К неселективным препаратам прямого действия относятся ингибиторы фузии (умифеновир, энисамия йодид), ингибиторы репликации (риамиловир) и ингибиторы эндонуклеазы (фавипиравир; зарегистрирован для лечения гриппа только в Японии).
К неселективным препаратам непрямого действия относятся интерфероны и другие иммуномодулирующие препараты.
На момент проведения вебинара Минздрав РФ готовит к выходу обновленную редакцию клинических рекомендаций по ведению больных с ОРВИ. В этом документе среди препаратов для этиотропной терапии упоминаются риамиловир, умифеновир и энисамия йодид.
В опубликованных рекомендациях по лечению гриппа у взрослых приведен список факторов, влияющих на выбор тактики лечения: возраст пациента, характер сопутствующих заболеваний, клиническая форма, характер течения, тяжесть заболевания, наличие и характер осложнений. Также прописаны предпочтительные препараты для лечения каждой группы больных. В частности, пациентам, не относящимся к группам риска, у которых болезнь протекает без осложнений, не рекомендуется назначение ингибиторов нейраминидазы. Крайне важна приверженность пациентов к лечению — если не соблюдается режим приема препарата, это может привести к появлению и распространению устойчивых форм вируса.
Докладчик подробнее рассмотрел два препарата. Первый из них, Триазавирин, показал большую эффективность в лечении гриппа в сравнении с Тамифлю (включая отсутствие развития пневмонии как осложнения) и в сравнении с плацебо для лечения ОРВИ. Балоксавир (Ксофлюза) примечателен тем, что его принимают только один раз в день, и это облегчает для пациента соблюдение назначений.
Далее Дмитрий Анатольевич перечислил критерии обязательного начала противовирусной терапии вне зависимости от истории вакцинации: госпитализация с диагнозом «грипп», тяжелая или прогрессирующая форма заболевания у амбулаторных больных, высокий риск осложнений у амбулаторных больных, возраст младше двух лет или старше 65 лет, а также беременность и двухнедельный период после родов. Данные критерии не зависят от продолжительности заболевания.
Противовирусные препараты можно назначать амбулаторным пациентам, болеющим в течение двух и менее дней (при нормальном течении заболевания противовирусные препараты обычно не требуются), амбулаторным больным и медицинским работникам, контактирующим с представителями групп риска по развитию осложнений. Особенное внимание должно уделяться людям, контактирующим с иммунодефицитными больными.
В целом при этиотропной терапии необходимо максимально раннее начало лечения.
Дмитрий Анатольевич заметил, что хотя клинические рекомендации направляют и защищают медицинских работников, они не могут заменить профессиональное и клиническое мышление врача. Именно на лечащем враче лежит ответственность за уместное применение клинических рекомендаций.
В заключение Лиозонов обратил внимание, что пандемия COVID-19 сформировала несколько пренебрежительное отношению к другим респираторным инфекциям, но в то же время способствовала развитию новых методов диагностики и терапии.
Отвечая на вопросы, докладчик объяснил, что этиотропная терапия не влияет на постинфекционный иммунитет, но может способствовать более быстрому восстановлению после болезни (снижению постинфекционной астении).
Следующий доклад — «Лечение ОРВИ у детей» — представила главный внештатный сотрудник по инфекционным болезням у детей комитета по здравоохранению Правительства Санкт-Петербурга Елена Дондурей. Нужно ли вообще лечить ОРВИ у детей? С одной стороны, ОРВИ, как правило, самоограничивается и требует минимального вмешательства. С другой стороны, инфекции нижних дыхательных путей входят в десятку главных причин смертности в мире (хотя частота летальных исходов в последние года несколько снизилась). В России же инфекции нижних дыхательных путей входят в пятерку наиболее частых причин смерти для младших возрастных групп (до 14 лет) — для детей до года на первом месте, для детей 1-4 лет на втором.
Медицинская помощь при лечении ОРВИ оказывается в рамках установленных стандартов и клинических рекомендаций, однако не для всех типов заболеваний такие рекомендации разработаны в полном объеме. Также необходимо учитывать, что происходит постоянная перерегистрация лекарственных средств, поэтому следует регулярно проверять их по реестру. Не стоит забывать и о санитарно-эпидемиологических требованиях, относящихся к инфекционным заболеваниям (СанПиН 3.3686-21). В них описаны порядок назначения лабораторных тестов и постановки клинического диагноза, а также продолжительность изоляции пациентов с респираторными вирусными инфекциями. Елена Александровна привела список нормативных документов, касающихся оказания помощи детям при респираторных инфекциях. Данные документы были изданы в 2012 году.
В настоящее время происходит переход на новые клинические рекомендации по лечению ОРВИ у детей, однако он еще не завершен. Документы, опубликованные на сайте Минздрава, не покрывают все связанные с респираторными инфекциями коды МКБ, в частности, не захватывают грипп и инфекции, поражающие нижние дыхательные пути. Из-за несовершенства регуляторной базы в большинстве случаев врачи при выборе лечения руководствуются сразу несколькими документами. Обновленные клинрекомендации должны перекрыть все шифры МКБ, связанные с респираторными инфекциями.
Елена Александровна отметила, что разнообразные осложнения, включая полиорганное, возможны практически при любой вирусной инфекции. Более того, осложнения, связанные с наслоением вторичной инфекции, могут наступать с первых дней заболевания, а не спустя семь дней от начала, как часто считается. Большую роль в развитии осложнений играет обострение хронических заболеваний.
Докладчица повторила слова Дмитрия Анатольевича о «трех китах» терапии ОРВИ, о необходимости индивидуального подхода, динамического наблюдения за пациентом и адекватной интерпретации клинрекомендаций. Так, рекомендации по питьевому режиму при ОРВИ часто игнорируются, что приводит к обезвоживанию.
В рамках динамического наблюдения за амбулаторными больными необходимо информирование родителей (в виде памяток и списка «красных флагов») обо всех возможных признаках ухудшения состояния ребенка, при которых необходим повторный вызов врача. Законные представители ребенка должны быть уведомлены о двух возможных течениях заболевания — гладком, с постепенным исчезновением симптомов, при котором требуется только посещение педиатра на выписку; и негладком, сопровождающимся усилением интенсивности симптомов или появлением новых.
Елена Александровна привела показания для госпитализации детей с ОРВИ, которые в основном связаны с интенсивностью интоксикации и дыхательной недостаточности и развитием неотложных состояний (судороги, шок и пр.).
Для этиотропной терапии в клинрекомендациях для детей указаны только осельтамивир и занамивир и топические формы интерферона. В готовящихся к выходу рекомендациях более подробно прописан список препаратов и критерии их назначения.
Докладчица отметила, что выбор препаратов зависит от предполагаемой этиологии заболевания. Для определения этологии, в свою очередь, необходимо знание о циркулирующих в данный момент возбудителях. Так, в настоящее время наблюдается высокая частота инфекций риновирусом, в то время как гриппа практически нет. Такой же принцип относится и к бактериальным возбудителям заболеваний (сейчас высока частота микоплазменных инфекций).
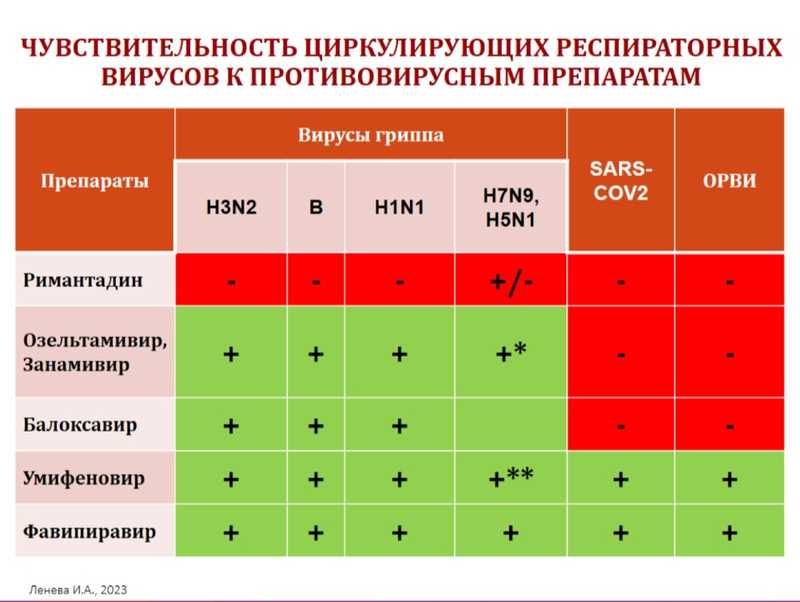
Елена Александровна привела сводную таблицу спектра действия различных противовирусных препаратов и еще раз напомнила, что римантадин в настоящее время не применяется. К препаратам узкого спектра (только против вирусов гриппа) относятся озельтамивир, занамивир и балоксавир. К препаратам широкого спектра — умифеновир (у детей) и фавипиравир (у взрослых).
Много внимания в клинических рекомендациях уделено симптоматической и патогенетической терапии. По словам докладчика, элиминационная терапия для детей стоит на втором месте после противовирусной, так как дети, особенно младшего возраста, не способны самостоятельно обеспечить проходимость дыхательных путей. Также часто используется жаропонижающая терапия (парацетамол и ибупрофен). Сосудосуживающую терапию необходимо подбирать с осторожностью, так как препараты ультракороткого действия может вызвать побочные эффекты при излишнем применении. Мало описана терапия при кашле, указано, что противокашлевые препараты не используются. По словам Елены Александровны это верно для острого ринофарингита, однако назначение противокашлевых и муколитических препаратов необходимо при поражении нижних дыхательных путей. Также она обратила внимание на высокую частоту атипичной флоры, включая коклюш и паракоклюш, при которых противокашлевые препараты также необходимо. Антигистаминные препараты следует назначать при проявлении аллергий. Ингаляционная терапия тоже не прописана в клинрекомендациях, однако есть методические рекомендации по ингаляционной терапии А.В. Орлова и В.С. Матвеева. Антибактериальная терапия не применяется при ОРВИ, если нет подтвержденного участия бактериальной флоры в развитие болезни.
Елена Александровна подчеркнуло, что пациенты с ОРВИ должны получать минимум препаратов и назначение каждого из них должно быть обосновано. При одновременном приеме шести и более препаратов риск взаимодействия между ними достигает 40%, соответственно, высок риск нежелательных эффектов.
О перспективах создания универсальной противогриппозной вакцины» рассказал Андрей Егоров, ведущий сотрудник НИИ гриппа. Геном вируса гриппа состоит из восьми фрагментов внутри вириона, которые при коинфекции разными вирусами могут «тасоваться как колода карт», сказал докладчик. Так происходит комбинирование геномов вирусов, циркулирующих в популяциях разных видов животных, приводящее к внезапному возникновению новых штаммов и развитию пандемий, как было последний раз в 2009 году. Возникновение новой пандемии гриппа — это только вопрос времени. В качестве примера докладчик напомнил о пандемии «испанки», унесшей жизни 100 миллионов человек в начале ХХ века.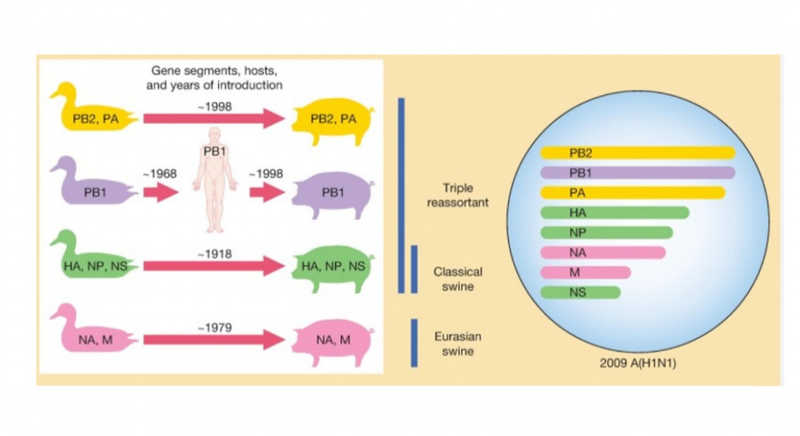
Методы, при помощи которых вирус гриппа «обманывает» врачей, уходя от лекарств и иммунного ответа, — это антигенный дрейф (накопление мутаций) и шифт (передача генов между штаммами). Противодействовать им можно за счет сезонной корректировки состава вакцины и нацеливания на консервативные эпитопы B- и Т- клеток. Другой инструмент в арсенале вируса — иммуносупрессия с помощью белка NS1. С этим можно бороться путём применения адъювантов и нарушения функции белка NS1. Затем Андрей Юрьевич разобрал эти аспекты более подробно.
Явление гетеротопического иммунитета (развитие после перенесенной болезни устойчивости к другим штамма возбудителя) было описано после пандемии 1957 года, когда люди, переболевшие штаммом H1N1, оказались более устойчивыми к штамму H2N2. Это явление связано как раз с развитием иммунного ответа на более консервативные внутренние структуры вириона. Эти структуры недоступны антителам, но когда они презентируются на поверхности зараженных клеток, они могут быть доступны Т-клеткам, Консервативность таких внутренних белков способна превышать 90% на протяжении многих десятилетий, и даже между вирусами гриппа А и B наблюдается гомология по ряду генов вплоть до 58%. Таким образом, существует возможность вызвать Т-клеточный ответ, который будет эффективен против очень широкого спектра вирусов.
Большое значение имеет способ администрации вакцины. Андрей Юрьевич привел данные, полученные его группой, по сравнению интраперитонеальной и назальной администрации натурального вируса и вакцины против вируса гриппа штамма H1N1. При инъекционной администрации вакцина обеспечивала полную защиту от гомологичной инфекции, частичную от инфекции вирусом штамма H3N2 и практически не защищала от вируса гриппа B. В то же время при назальной администрации как вакцины, так и натуральной инфекции развивалась устойчивость не только к гомологической, но и к гетерологической инфекции вирусами гриппа А и B. Таким образом, формирование местного Т-клеточного иммунитета теоретически способно создать защиту от всех вирусов гриппа.
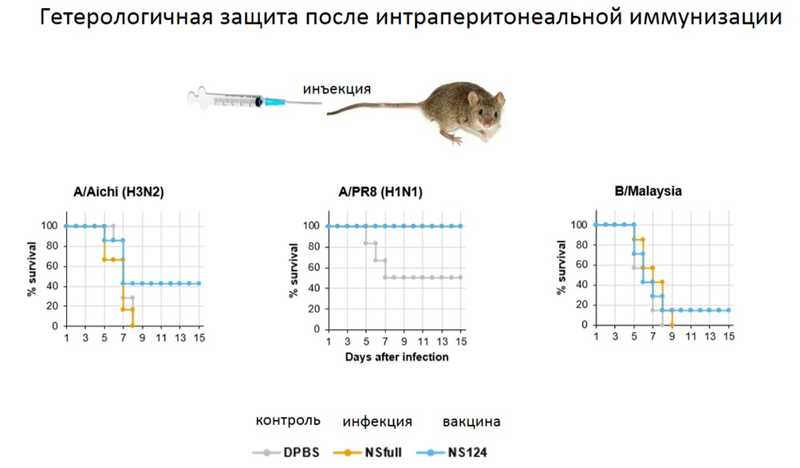
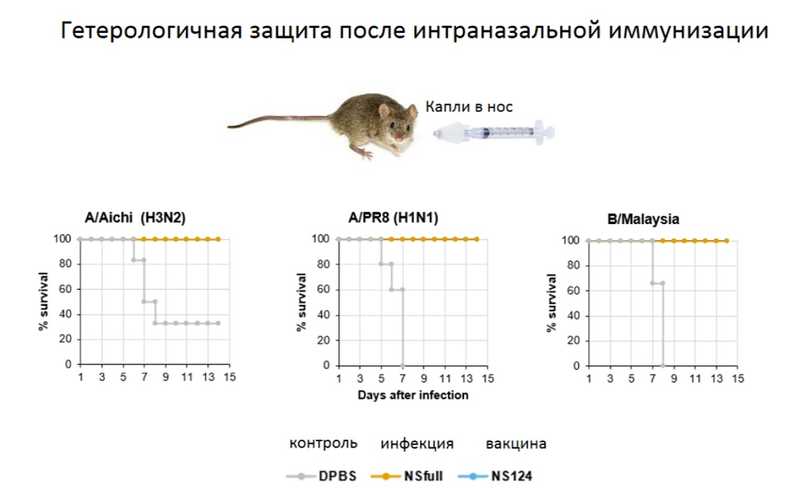
Было показано, что назальная иммунизация способствует развитию трех ветвей иммунного ответа — это создание популяции резидентных Т-клеток в респираторном тракте, создание популяции регуляторных Т-клеток и обеспечение кросс-протективного иммунитета за счет иммуноглобулинов класса А.
Иммуногенность консервативных эпитопов вируса можно также повысить за счет применения мукозальных адъювантов, например интерлейкина 1β. Использование аденовирусного вектора, экспрессирующего IL-1β, значительно повышало эффективность интерназальной вакцинации, провоцируя ответ CD8+ Т-клеток.
Иммуносупрессивное действие вируса можно подавить нарушением функции белка NS1. Вирус с укороченным NS1 или без него теряет способность размножаться в респираторном тракте. Также нокаут NS1 приводит к активному цитокиновому ответу в месте введения вакцины. При разработке вакцины последовательность NS1 может быть заменена трансгенными последовательностями, принадлежащими другим патогенам, что позволяет проводить одновременную иммунизацию против гриппа и других заболеваний, таких как туберкулез или РСВ.
В тестах на хорьках однократная интраназальная вакцинация вирусом штамма H1N1 с модифицированным геном NS1 (его заменили на консервативные последовательности вируса гриппа) обеспечивала полную защиту при заражении через 28 дней гетерогенным высокопатогенным штаммом H5N1. Смертность снижалась с 40% до 0%, вирус почти полностью элиминировался на четвертый день после инфекции. В контрольной группе высокий титр вируса сохранялся до шестого дня.
В США в данный момент начинаются клинические исследования универсальной вакцины против гриппа. Однако вакцина является инъекционной, что докладчик назвал «наступанием на те же грабли».
В настоящее время в Институте гриппа ведутся разработка и клинические исследования вакцин на основе гриппозного вектора с инактивированным белком NS1. Этот подход позволит получить вакцины против туберкулеза, SARS-CoV-2, РСВ и, возможно, универсальную гриппозную вакцину.
Отвечая на вопрос о вакцинации пациентов с иммунодефицитами, Андрей Юрьевич сказал, что в этом случае необходимо использование инактивированных вакцин, которые также могут администрироваться интраназально.
Доклад «Экспресс-диагностика гриппа и ОРВИ. Взгляд разработчика» представил ведущий ученый ООО «Рапид Био» Владислав Иванов. Он подчеркнул, что во время пандемии COVID-19 на первую линию диагностики вышли экспресс-тесты — по данным FIND, именно они использовались для постановки большинства диагнозов. Чаще всего проводились тесты на антиген COVID-19 в мазках из носоглотки.
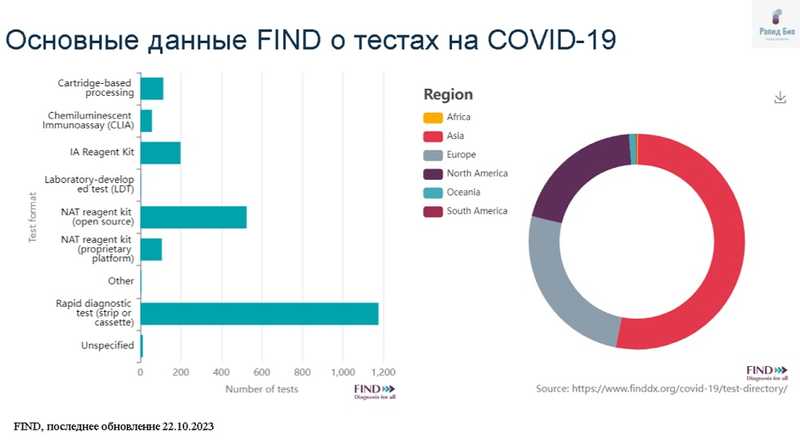
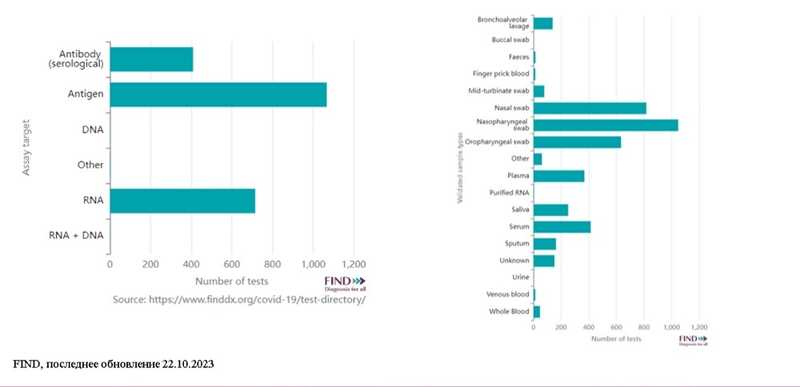
Разработка экспресс-тестов связана с решением технологических задач, таких как выбор оптимального маркера, выбор составляющих мультимембранного композита, выявление аналита в образцах с низкой концентрацией и образцах сложного типа; также необходимо учитывать постоянную изменчивость патогенов.
Владислав Сергеевич коротко рассказал о принципе работы экспресс-тестов на Грипп A/B и комбо тестов на Грипп A/B и COVID-19, разработанных в «Рапид Био». Образец наносится на специальную подложку, под действием капиллярных сил жидкость диффундирует вдоль поверхности тест-полоски и при этом проходит через подложку с конъюгатом, который представляет собой маркер с иммобилизованными на нем биоспецифическими молекулами (антителами). При наличии антигена в образце он сначала связывается с этими антителами , а затем с антителами в определенном участке тест-полоски. Образуется так называемый сэндвич, и наблюдается видимое окрашивание полоски. Также на тесте присутствует контрольная линия, присутствие которой подтверждает, что результат достоверен.
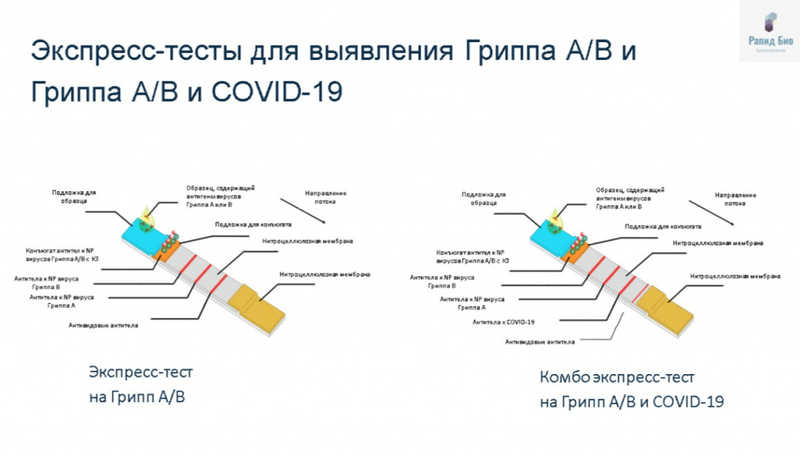
Разработка подобных тестов занимает от трех месяцев до года, сказал докладчик. Стандартная процедура включает в себя возникновение идеи, аналитическую стадию (изучение литературы и рынка), утверждение проекта, заказ реагентов, непосредственно разработку, выпуск пилотной партии, регистрацию и выход теста на рынок. Внешняя апробация экспресс тестов проводилась преимущественно в НИИ гриппа им. Смородинцева. «Рапид Био» разрабатывает тесты на широкий спектр вирусов гриппа, причем они обладают хорошим лимитом детекции, повторяемостью и специфичностью. Так, не возникает кроссреактивности между гриппами A и B.
На данный момент компания производит 10-12 миллионов тестов в месяц. Прежде всего это тесты на COVID-19, грипп и комбинированные тесты на эти две инфекции.
В завершение доклада Владислав Сергеевич еще раз перечислил преимущества экспресс-тестов: простота применения и интерпретации, скорость получения результатов, отсутствие необходимости в сложном оборудовании и пробоподготовке, возможность использования как в стационаре, так и в полевых условиях, небольшой объем образца, экономичность, возможность определения нескольких аналитов одновременно и хорошее соотношение чувствительности и специфичности.
Следующий доклад — «Сезонный мониторинг и информативность лабораторной диагностики респираторных инфекций» — представила старший научный сотрудник лаборатории ПЦР компании «Вектор-Бест» Юлия Томилова. Она рассказала о совместной работе компании с ГБУЗ Новосибирской области «Детская городская клиническая больница №3».
С сентября 2022 по июнь 2023 года было проанализировано 1443 носоглоточных мазка детей, поступивших в стационар с симптомами респираторного заболевания. Методом ПЦР выявлялись 16 наиболее распространенных вирусов, 11 бактерий, грибы с дифференциацией C albicans.

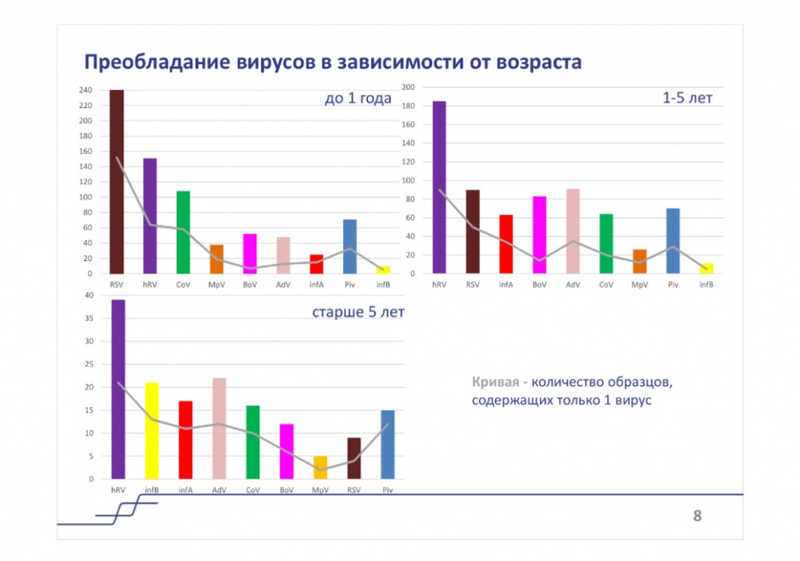
Полученные данные о встречаемости патогенов за сезон 2022-2023 гг. в целом соответствовали всероссийским данным о циркуляции возбудителей, приведенным в докладе Дарьи Михайловны. При этом Юлия Эдуардовна отметила высокий уровень сочетанных инфекций. Так, образцов, в которых идентифицировался один вирус, в различных возрастных группах было около 50%, образцов с двумя идентифицированными вирусами — около 20%, с тремя и более — на уровне 1–4%. При этом с возрастом растет количество образцов, в которых не обнаруживались вирусы (16% у детей до года, 36% у детей старше 5 лет). Это может быть связано с тем, что маленькие дети в большинстве случаев впервые встречаются с наиболее распространенными вирусами, и это приводит к развитию тяжелого заболевания, в то время как старшие дети более устойчивы к распространенным возбудителям, но могут заражаться более редкими вирусами, которые не идентифицировались в данном исследовании.
Для проверки качества образца оценивалось количество ДНК человека в мазке (по аналогии с тестированием на ВПЧ). В образцах, в которых не было идентифицировано вирусов, содержание ДНК человека было недостаточным (менее 10 тысяч копий/мл) почти в два раза чаще, чем в целом по данной возрастной группе.
Юлия Эдуардовна привела данные по преобладанию вирусов в разных возрастных группах на конец марта и на конец июня, как в целом по группе, так и для образцов, содержащих только один вирус. Картины существенно различались во всех группах. У детей до года РСВ оставался на первом месте по частоте, а в остальных группах лидирующую позицию занимал риновирус. Примечательно, что одни вирусы приводили к развитию тяжелых заболеваний сами по себе, а другие только при сочетанных инфекциях.
Все респираторные инфекции вызывали пневмонию примерно с одной и той же частотой. При этом бронхиты были характерны только для ряда вирусов, включая РСВ и парагриппы. Вирусы гриппа чаще всего вызывали только ОРВИ.
В отличие от Санкт-Петербурга, не наблюдалось высокой частоты микоплазменной инфекции, однако выявлялись инфекции другими бактериями, например, представителями рода Bordetella. Лидирующие позиции занимали условно-патогенные бактерии, такие как Streptococcus pneumoniae. Встречаемость условно-патогенных бактерий при тех или иных вирусных инфекциях подчинялась определенным закономерностям. Так, гемофильная палочка при аденовирусной инфекции выявлялась заметно чаще, чем в среднем по популяции.
Юлия Эдуардовна рассказала о нескольких клинических случаях, в которых ПЦР анализ помог своевременно поставить диагноз. Например, у шестимесячного ребенка был идентифицирован в мазке грипп B, что позволило назначить противогриппозный препарат, и ребенок выздоровел. Во втором случае у семимесячного пациента выявили РСВ и прописали иммуноглобулин человека, что также привело к выздоровлению. В третьем случае при повторной госпитализации у ребенка были выявлены сразу пять респираторных вирусов, бактериальная и грибная инфекция. Докладчица подчеркнула необходимость тестирования на грибные инфекции, которыми часто пренебрегают.
Исследование планируется продолжать в текущем эпидсезоне с участием взрослых пациентов, сказала в заключение Юлия Томилова.
С докладом «Готовое решение по выявлению ДНК/РНК контаминации в ПЦР лабораториях» выступила руководитель группы молекулярной генетики ООО «Альгимед Техно» Янина Бандык. В список продуктов компании «Альгимед Техно» входят ИФА-наборы, решения для масс-спектрометрии, ПЦР тест-системы, продукты для выделения и очистки ДНК, решения для цитологического скрининга и диагностики рака шейки матки, тест системы на основе уровня экспрессии микроРНК и продукция для выявления эндотоксинов и пирогенов. Производство сертифицировано по стандартам ISO 9001:2015 и 13485:2016, подчеркнула докладчика.
Одно из полезных готовых решений, представленных компанией, — набор для выявления следовых количеств нуклеиновых кислот в ПЦР лабораториях. Контаминация — непреднамеренное загрязнение рабочих зон, оборудования, одежды и других предметов в лаборатории плазмидной или бактериальной ДНК, вирусной ДНК и РНК, геномной ДНК и РНК человека и животных, ПЦР продуктами — приводит к ложноположительным результатам ПЦР анализа и является острой проблемой в лабораториях любого профиля.
Контаминации способствуют большие объемы исследований, технические ошибки сотрудников, накопление образцов в лаборатории, загрязнение поверхностей при открытии пробирок и отсутствие регулярного внутрилабораторного контроля качества работы. На контаминацию указывают положительные результаты в отрицательных контролях, резкое увеличение положительных проб и отсутствие N/A (не детектируемых) проб в постановках ПЦР. Также она может проявляться в виде положительных результатов в отрицательных пробах на последних циклах ПЦР.
Последствия контаминации включают в себя выдачу ошибочных результатов или задержку выдачи, потерю реагентов и материалов, потерю времени и сил персонала.
Для выявления следовых количеств ДНК и РНК в лабораториях «Альгимед Техно» предлагает набор Cleancheck DNA-RNA Free. Он позволяет выявлять тип контаминации и её локализацию, осуществлять внутрилабораторный контроль контаминации и контроль остаточного уровня загрязнения после мероприятий по деконтаминации. Янина Александровна отметила необходимость еженедельного контроля контаминации в ПЦР-лаборатории.
Преимущества набора — отсутствие необходимости выделения нуклеиновых кислот, возможность выявления ДНК/РНК на различных поверхностях, в оборудовании и реагентах, выявление типа контаминации и ее локализации и быстрое (в течение трех часов) получение результатов.
Заключительный доклад — «Современные вирусы и синдромный подход в диагностике респираторных инфекций» — представила Любовь Станкевич, к.м.н., директор по лабораторной медицине компании LabQuest. Любовь Ивановна привела краткую историю возбудителей исторических пандемий, в частности, рассказала о первой всемирной респираторной пандемии — «русского гриппа», унесшей жизни более миллиона человек. Современные исследования показали, что возбудителем «русского гриппа», скорее всего, был коронавирус ОС43.

К началу XXI века коронавирусы рассматривались только как ветеринарная проблема. Однако уже в 2002 году SARS-CoV проник в популяцию людей из популяции летучих мышей Юго-Восточной Азии. В 2012 году были обнаружены очаги MERS-CoV на территории Аравийского полуострова.
Подобные процессы наблюдаются и для вируса гриппа. Грипп у птиц описывался уже с конца XIX века, однако на тот момент не было методов идентификации. В 1959 году был выделен и описан штамм H5N1. В XX веке эпидемии птичьего гриппа произошли в Азии, Европе, Африке и Америке. В 2022 году зафиксирован переход H5N1 от птиц к млекопитающим — эпидемии у тюленей в Америке и у норок в Испании. В начале XXI века зафиксирован переход H5N1 к человеку. В данный момент ожидается переход подтипа данного штамма H10N3 от птиц к человеку. При этом у H5N1 смертность с 1997 по 2023 гг. составила более 50% (457 из 868 заразившихся). Пока не зарегистрировано случаев передачи данного вируса от человека к человеку, однако такой эпизод мог бы положить начало пандемии.

Диагноз ОРВИ является слишком широким и неспецифичным, отметила докладчица. В настоящее время существует возможность быстро и точно определить этиологию респираторной инфекции. Человечество не может позволить себе пропускать появление новых опасных штаммов, путать возбудители между собой и пропускать коинфекции. Из этого следует, что необходимо максимально быстро выявлять этиологию заболевания.
Любовь Ивановна привела данные, собранные в лабораториях LabQuest за предыдущий эпидсезон. Гриппы А и B выявлялись примерно с равной частотой. При этом наблюдалась упомянутая в предыдущих докладах смена преобладания штаммов в течение сезона.
Полученные данные также опровергают типичное представление о том, что ОРВИ летом — на самом деле скорее всего ангина. Уровень выявления вирусов при диагнозе ОРВИ в летние месяцы был сравним с зимними. Подобная статистика и анализ эволюции современных вирусов говорят о том, что при диагнозе ОРВИ этиология заболевания не может быть определена по сезонности, симптоматике и прочим косвенным признакам.
Таким образом, существует необходимость в смене парадигмы диагностики респираторных заболеваний. Нужен синдромный подход — одновременное выявление широкого спектра патогенов, ассоциированных с группой клинически (и/или морфологически) подобных заболеваний. При таком подходе врачу для определения этиологии ОРВИ необходимо лишь запросить тестирование по «респираторной панели», которая должна включать максимальное количество возможных возбудителей. Синдромный подход стал возможным за счет развития технологий мультиплексного тестирования методом ПЦР.
Лаборатория LabQuest предлагает респираторную панель, позволяющую осуществлять дифференциальную диагностику 18 респираторных инфекций за один день на основе одного мазка из носоглотки, а также удобные наборы для самостоятельного взятия мазков, сохранения и транспортировки образца в лабораторию.
В заключение Дарья Михайловна Даниленко поблагодарила слушателей и пригласила всех участвовать в будущих вебинарах.


 Меню
Меню





 Все темы
Все темы




 0
0








