Хороший, плохой, злой… Как приручить вестерн-блот?
О таком популярном методе анализа белков, как вестерн-блоттинг, без сомнения, слышали все, кто интересуется молекулярной биологией. Он имеет множество преимуществ и хорош в решении самых разных задач. В то же время этот метод весьма своенравен, длителен и трудоемок. Не одно поколение аспирантов и молодых сотрудников с ужасом обнаруживало на своих блотах вместо долгожданных красивых полосок нечто напоминающее ухмылку злодея. Поэтому, чтобы упростить жизнь исследователям, специалисты из компании GenScript разработали линейку реагентов, расходных материалов и оборудования для комфортного проведения вестерн-блоттинга.

Что вы узнаете:
Что это за метод, какие этапы он включает и при чем тут вестерны?
Вестерн-блоттинг: хороший или плохой?
Для каких задач хорош вестерн-блоттинг?
Что делать, если ваш вестерн-блот получился «злым»?
Продукция GenScript: чтобы вестерн всегда был хорошим
Что это за метод, какие этапы он включает и при чем тут вестерны?
Вестерн-блоттинг — золотой стандарт для обнаружения и характеристики белков. В основном его используют для идентификации конкретного белка в сложной смеси, ведь метод позволяет определить его молекулярную массу. Также он известен как белковый иммуноблот, так как для специфического обнаружения искомого белка используются антитела.
Метод был предложен в 1979 году группой ученых из Швейцарии (Г. Таубин, Т. Стехлин, Дж. Гордон). «Западное» название ему было дано несколько позднее, в 1981 году, У. Нейлом Барнеттом по аналогии с саузерн-блоттингом — методом для изучения ДНК, который был назван в честь разработавшего его британского ученого Эдвина Саузерна. Существуют еще и нозерн-блоттинг для определения РНК, и истерн-блоттинг для характеристики пострансляционных модификаций белков — ни одна сторона света не осталась без внимания молекулярных биологов.
Методика проведения вестерн-блоттинга состоит из нескольких этапов: разделение белков по размеру, перенос на твердую подложку и идентификация целевого белка [1].
1) Белки в составе изучаемого образца разделяют с помощью электрофореза в полиакриламидном геле. На этом этапе под воздействием электрического поля белки мигрируют в геле и разделяются по размеру и заряду. Если на этом этапе провести окраску геля, они будут визуализироваться в виде набора полос.
2) Далее белки переносятся на твердую подложку, обычно на мембрану из нитроцеллюлозы или поливинилидендифторида (ПВДФ), также под воздействием электрического поля. Данный процесс как раз и называется блоттингом. Во время этой процедуры гель и мембрану помещают в устройство для переноса между двумя листами фильтровальной бумаги. При этом белки на мембране сохраняют свои относительные положения, полосы расположены так же, как в геле. Часто после переноса проводят окрашивание общего белка красителями, например кумасси R-250, Понсо S или другими, для контроля успешности переноса.
3) Чтобы предотвратить неспецифическое связывание первичных и вторичных антител с мембраной, проводят блокирование мембраны. В большинстве случаев для этого используют обезжиренное сухое молоко или раствор бычьего сывороточного альбумина. Кроме того, существует множество коммерческих блокирующих буферов.
4) Наконец, мембрану инкубируют с первичным антителом, специфичным в отношении искомого белка. А потом добавляют меченые вторичные антитела, специфичные к первичным антителам, что позволяет косвенно визуализировать изучаемый белок. Как правило, вторичные антитела ковалентно соединены с ферментами (пероксидаза хрена, щелочная фосфатаза), которые образуют окрашенный осадок при взаимодействии с хромогенным субстратом. В результате на мембране можно увидеть видимую цветную полосу в том месте, где первичное антитело связано с белком, и определить его молекулярную массу.
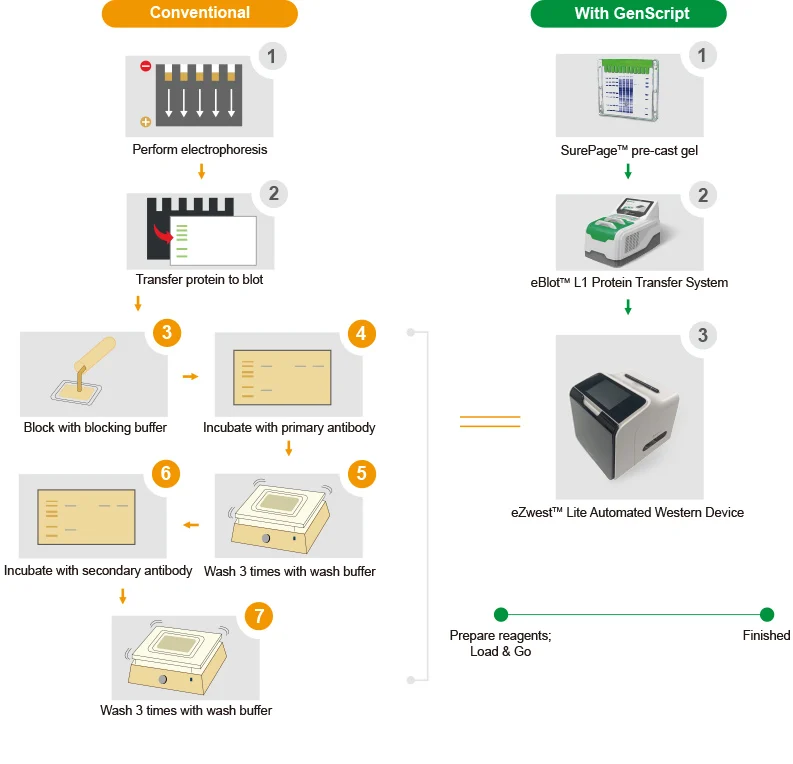 Продукция компании Genscript позволяет сократить этапы вестерн блоттинга до 4 шагов.
Продукция компании Genscript позволяет сократить этапы вестерн блоттинга до 4 шагов.
Вестерн-блоттинг: хороший или плохой?
Среди достоинств метода можно выделить в первую очередь высокую чувствительность и специфичность. Он позволяет обнаружить даже небольшие количества белка и подходит для идентификации незначительных изменений в уровнях экспрессии, а сочетание гель-электрофореза и специфичных взаимодействий антиген-антитело помогает селективно выявлять искомые белки даже в сложных смесях. Он дает возможность получать полуколичественные и количественные данные об уровнях экспрессии белков путем сравнения интенсивности сигнала с контролями и стандартами. Кроме того, метод достаточно универсален и может быть использован для самых разных целей. Наконец, несомненным плюсом метода является то, что вестерн-блоты можно хранить и повторно исследовать.
К ограничениям метода относится в первую очередь трудоемкость его постановки. Весь процесс отнимает очень много времени (до нескольких дней), требует точного и тщательного выполнения каждого шага, причем незначительные ошибки или изменения в протоколах могут существенно испортить результат. Еще один важный недостаток — высокая стоимость метода, так как он требует использования дорогих антител и специализированного оборудования. Далее, вестерн-блоты могут давать ложноположительные или ложноотрицательные результаты из-за неспецифического связывания антител или неполного переноса белков, соответственно. Наконец, интерпретация результатов зависит от опыта и субъективного суждения сотрудника.
Для каких задач хорош вестерн-блоттинг?
Так как метод является универсальным, его приложения варьируют от фундаментальных исследований до диагностики различных заболеваний. Вот некоторые из основных его применений:
-
Идентификация белка. Возможна благодаря электрофоретическому разделению и применению специфичных антител.
-
Оценка размера белковой молекулы. Можно сравнить характер миграции и положение белковых полос на мембране с известными маркерами молекулярных масс.
-
Оценка количества белка в образце. Выполняется путем сравнения интенсивности или плотности белковых полос.
-
Обнаружение различных изоформ белка [1]. Например, для этого сравнивают полосы белка из образца больного с полосами из образца здорового человека.
-
Изучение РНК-белковых, ДНК-белковых и белок-белковых взаимодействий или посттрансляционных изменений (метилирования, гликозилирования, фосфорилирования, сумоилирования, убиквитинилирования) [1, 2, 3, 4].
-
Диагностика онкологических, аутоиммунных и неврологических заболеваний [1, 5]. Детектируют такие маркеры, как гиперэкспрессия белка PFN1 при раке гортани, белок GSTO1 при раке пищевода и переносчик лекарств ABCG2 при болезни Альцгеймера.
-
Диагностика инфекционных заболеваний [1, 6, 7, 8]. Метод используется для серодиагностики туберкулезного менингита и нейроцистицеркоза, в качестве тестов на ВИЧ, гепатит В, болезнь Лайма и другие, а также на прионные заболевания, такие как вариант болезни Крейтцфельдта-Якоба (vCJD) и губчатая энцефалопатия крупного рогатого скота (BSE).
Что делать, если ваш вестерн-блот получился «злым»?
|
Проблема |
Возможная причина |
Как исправить |
|
Нет полос |
Не прошел перенос |
Проверить, что мембрана надлежащим образом смачивается буфером или метанолом и что между мембраной и гелем есть хороший контакт. |
|
Взяли неподходящие вторичные антитела |
Проверить соответствие вторичных и первичных антител. |
|
|
Антитела испортились, или у них закончился срок годности |
Проверить срок годности, приобрести свежие антитела, следовать рекомендациям по хранению и избегать циклов замораживания-оттаивания. |
|
|
Произошло загрязнение азидом натрия |
Убедиться, что используемые буферы не содержат азид натрия, поскольку он может подавлять сигнал пероксидазы хрена. |
|
|
Слабые полосы |
Низкое связывание белков с антителами |
Свести количество промывок к минимуму. Уменьшить концентрацию NaCl в буфере для блоттинга и растворе антител. |
|
Взяли недостаточное количество антител, или их аффинность к анализируемому белку слишком низкая |
Увеличить концентрацию антител в 2–4 раза. |
|
|
Взяли слишком мало белка |
Увеличить количество белка, наносимого на гель. |
|
|
Испортился конъюгат |
Смешать фермент и субстрат в пробирке. Если цвет не развивается или получается слабым, сделать свежие реагенты или купить новые. |
|
|
Проявились лишние полосы |
Произошло неспецифическое связывание первичных антител |
Уменьшить концентрацию первичных антител и количество общего белка, загружаемого в гель. Использовать моноспецифические антитела. |
|
Произошло неспецифическое связывание вторичного антитела |
Провести контроль только с вторичным антителом (исключая первичное антитело). Если появляются полосы, выбрать альтернативное вторичное антитело. |
|
|
Произошло неспецифическое связывание первичных или вторичных антител |
Добавить 0,1–0,5% Tween 20 к раствору антител и увеличить его концентрацию в промывочном буфере. Увеличить количество промывок. Увеличить концентрацию NaCl в буфере для блоттинга. |
|
|
Анализируемый белок деградировал |
Свести к минимуму циклы замораживания/оттаивания образца. Добавить ингибиторы протеазы в образец перед хранением. Сделать свежие образцы. |
|
|
Возможно, вы нашли что-то интересное! |
Если лишние полосы расположены выше искомого белка, это могут быть модификации, связанные с фосфорилированием или ацетилированием (масса белка увеличивается незначительно) либо с убиквитинированием или сумоилированием (масса белка увеличивается примерно на 20 КДа). |
|
|
Высокий фон |
Произошло неспецифическое связывание первичных антител |
Подобрать оптимальную концентрацию молока и NaCl в растворе первичного антитела. Уменьшить концентрацию антител. |
|
Молоко может содержать антиген-мишень или эндогенный биотин. Антитела распознали молочный белок. |
Заменить при блокировке свободных участков на мембране молоко на 3%-ный бычий сывороточный альбумин (BSA). |
|
|
Недостаточное количество промывок |
Увеличить количество промывок или концентрацию Tween 20 в промывочном буфере. |
|
|
Проявились неровные пятна |
Произошло загрязнение реагентов твердыми частицами или бактериями |
Приготовить свежие реагенты. |
|
Во время инкубации или промывки было недостаточное количество раствора |
Проверить, что мембрана полностью погружена в раствор на данных этапах. |
|
|
На мембрану во время переноса попали пузырьки воздуха |
Аккуратно удалить пузырьки воздуха, особенно во время переноса. |
|
|
Перемешивание во время инкубации было неравномерным |
Использовать качалку или шейкер. |
|
|
Грязное оборудование |
Помыть блок электрофореза. |
|
|
Произошла агрегация пероксидазы хрена |
Отфильтровать конъюгат и удалить агрегаты. |
|
|
Была сделана слишком длинная выдержка |
Уменьшить время выдержки. |
Продукция GenScript: чтобы вестерн всегда был хорошим
Этап электрофореза в полиакриламидном геле
- Камера для электрофореза GenBox . Позволяет проводить электрофорез белков одновременно в двух мини-гелях (10*8 см или 10*10 см). К ней в комплект можно приобрести модуль GenBox Mini Blot для традиционного влажного переноса.

- Готовые полиакриламидные гели SurePAGE. Позволяют сократить время анализа, получить четкие, достоверные результаты и стандартизировать эксперименты. Одно из их важных преимуществ — широкие лунки для удобного нанесения образца. Толщина гелей 1 мм, размер 10*12 см, количество дорожек — 10, 12 и 15, объем образца — до 80, 60 и 40 мкл в зависимости от количества дорожек. Доступны гели разной плотности.
- Маркеры молекулярного веса белков. Содержат наборы белков с известными молекулярными массами и зарядами, благодаря которым можно определить приблизительный размер исследуемого образца.
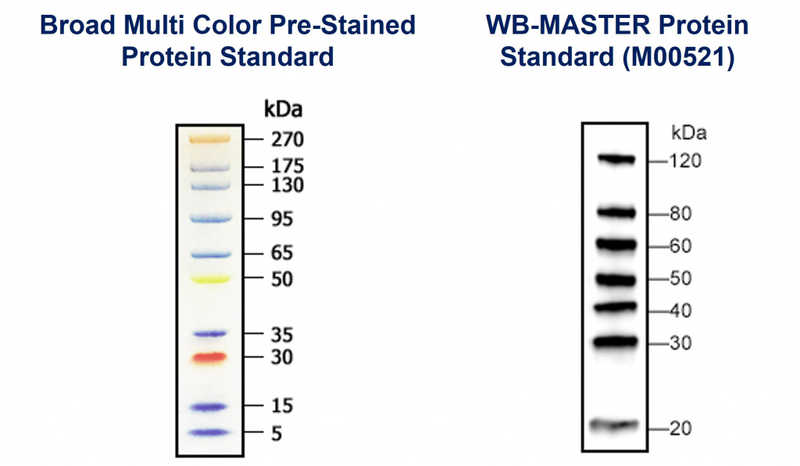
Например, цветной маркер Broad Multi Color Pre- Stained Protein Standard (M00624) позволяет отследить миграцию белков в процессе электрофореза, подтвердить эффективность переноса на мембрану, локализовать интересующий нас белок в подготовительном геле без дополнительной окраски и охарактеризовать его массу.
Маркер WB-MASTER Protein Standard предназначен непосредственно для вестерн-блоттинга. Он состоит из семи рекомбинантных белков с молекулярной массой от 20 кДа до 120 кДа, каждый из которых содержит сайт связывания IgG, способен взаимодействовать с первичными и вторичными антителами, полученными из широкого круга видов-хозяев. Визуализация этого маркера происходит вместе с образцами пользователей и не требует каких-либо дополнительных реагентов.
- Система для окрашивания белков eStain L1 . Объединяет три традиционных этапа работ: фиксация, окрашивание и обесцвечивание одного или одновременно двух гелей. Протокол занимает менее 10 минут. Чувствительность метода позволяет детектировать от 12,5 нг белка. По сравнению с традиционным окрашиванием система позволяет получить четкие синие полосы с минимальным фоном или даже без него. Это достигается за счет использования красителя кумасси бриллиантовый синий и запатентованной технологии окрашивания белков, разработанной Genscript.

Этап переноса белков с геля на мембрану
- Система для мокрого переноса белков eBlot L1 . Позволяет быстро перенести белки с одного или сразу с двух гелей на мембрану. Белки с малой, средней и большой молекулярной массой могут быть эффективно перенесены всего за 9–17 минут (в зависимости от протокола). Стандартные протоколы предназначены для переноса более крупных белков (до 400 кДа), в то время как длительность переноса белков меньшего размера (до 100 кДа) может быть значительно сокращена. Для заказа доступны готовые сэндвичи с буферами и PVDF-мембраной или без мембраны — для использования с нитроцеллюлозной или PVDF-мембраной по выбору. Установка таких сэндвичей проста и занимает менее 2 минут.

Блокирование, инкубация и промывка мембраны
- Автоматическая система для вестерн-блоттинга eZwest Lite . Объединяет этапы блокирования, инкубации антител и промывки мембраны в одном приборе. Данная система обеспечивает стабильные и воспроизводимые результаты после каждого запуска. Пользователю нужно только подготовить необходимые реагенты, запустить нужную программу, а eZwest Lite сделает все остальное.

Станция помогает существенно сэкономить время: классический протокол длится 4,5 часа, а также есть возможность постановки «ночного протокола», что позволит максимально ускорить эксперимент и быстрее приступить к этапу детекции результатов. Прибор прост в использовании и занимает минимум места.
При всех своих многочисленных преимуществах вестерн-блоттинг — весьма капризный метод. Он требует аккуратного и вдумчивого отношения, а без должного уважения результаты ваших экспериментов будут напоминать отпечатки копыт диких жеребцов на бескрайних равнинах Запада. Чтобы облегчить труд исследователей, оптимизировать процессы и минимизировать ошибки, компания GenScript, основываясь на многолетнем опыте и собственных разработках, предлагает реагенты и оборудование, позволяющие значительно сократить затраты времени. Для каждого этапа анализа существуют готовые решения, которые помогут приручить вестерн-блоттинг и смягчить его упрямый нрав, чтобы результаты всегда радовали вас своим хорошим качеством.

|
| Для заказа реагентов и оборудования обращайтесь по электронному адресу help@skygen.com, а все интересующие вопросы можно обсудить по телефону 8 800 775 04 19. |
Литература
1. H. Begum, et al. Western blotting: a powerful staple in scientific and biomedical research // Biotechniques. 2022. 73(1). DOI: 10.2144/btn-2022-0003
2. Л.К. Савинкова и др. Методы in vitro, используемые для изучения ДНК-белковых взаимодействий // Успехи современной биологии. 2020. 140(6), 540–554. DOI: 10.31857/S0042132420060071
3. Jia Y. et al. Southwestern Blotting Assay // Methods Mol Biol. 2015. 1334: 85-99. DOI: 10.1007/978-1-4939-2877-4_5
4. Jadwin J.A., et al. Detection and quantification of protein–protein interactions by far-western blotting // Methods Mol. Biol. 2015. 1312, 379–398. DOI: 10.1007/978-1-4939-2694-7_38
5. Sinkala E., et al. Profiling protein expression in circulating tumour cells using microfluidic western blotting // Nat. Commun. 2017. 8, 14622. DOI: 10.1038/ncomms14622
6. Zulfiqar H.F., et al. HIV diagnosis and treatment through advanced technologies // Front. Public Health. 2017. 5, 32. DOI: 10.3389/fpubh.2017.00032
7. Hernández-González A. et al. Comparison of T24H-his, GST-T24H and GST-Ts8B2 recombinant antigens in western blot, ELISA and multiplex bead-based assay for diagnosis of neurocysticercosis // Parasit. Vectors. 2017. 10(1), 237. DOI: 10.1186/s13071-017-2160-2
8. Bertoni T.A., et al. Western blotting is an efficient tool for differential diagnosis of paracoccidioidomycosis and pulmonary tuberculosis // Clin. Vaccine Immunol. 2012. 19(11), 1887–1888. DOI: 10.1128/CVI.00252-12
Реклама. Рекламодатель ООО "Скайджин"
Токен: LdtCJzwgG


 Меню
Меню





 Все темы
Все темы




 0
0