Хромосомное секвенирование выявляет причины аномалий у плода
Если беременность не завершилась рождением здорового ребенка, важно понять причину, прежде чем планировать следующую беременность. У половины плодов после спонтанных абортов обнаруживаются хромосомные аномалии. Диагностика хромосомных нарушений прошла долгий путь — от культивирования клеток плода и изучения хромосом под микроскопом до высокопроизводительного секвенирования. Какие преимущества дает секвенирование при поиске анеуплоидий, делеций и дупликаций, рассматриваем на примере продукта компании BGI Genomics «Хромосомное секвенирование VISTA™».
erid:2Vfnxwpjqk4
Что такое хромосомные аномалии?
Хромосомные аномалии возникают в результате делеций или дупликаций фрагментов хромосом или изменения числа хромосом. Они могут быть причиной прерывания беременности, а также рождения детей с тяжелыми врожденными аномалиями, интеллектуальными и физическими нарушениями.
Авторы статьи, вышедшей в Nature Medicine в 2023 году (в этой работе участвовали сотрудники Томского национального исследовательского центра РАН), проанализировали 1745 абортусов после спонтанного прерывания беременности. Примерно половина (50,4%) была кариотипически аномальной, причем частоту хромосомных аберраций увеличивал как возраст матери, так и возраст отца.
Данные компании BGI Genomics подтверждают наличие хромосомных аномалий в 56,4% образцов фетальных тканей, полученных после самопроизвольного аборта.
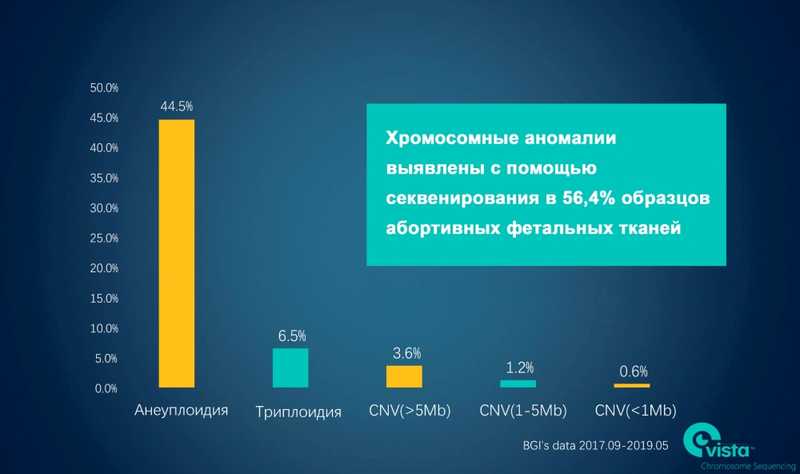
Какие бывают хромосомные аномалии?
Хромосомные аномалии делятся на две основные категории: числовые и структурные.
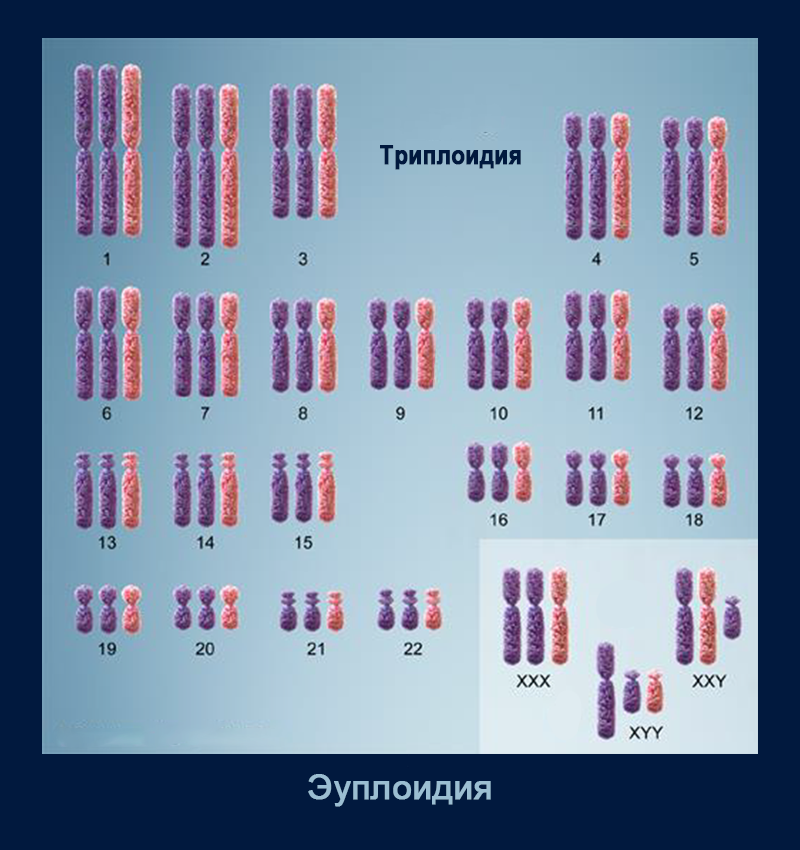
Числовые (количественные) аномалии встречаются чаще и представляют собой отклонения от нормального диплоидного числа хромосом. Отдельные хромосомы могут отсутствовать или дуплицироваться, то же может произойти с целым гаплоидным набором хромосом.
Структурные аномалии включают геномную перестройку одной или нескольких хромосом. Это потери участка (делеции), приобретение лишних копий (дупликации), изменение ориентации фрагмента в хромосоме (инверсии). Возникновение изохромосомы — двух копий одного плеча хромосомы, соединенных центромерой, с потерей второго плеча — можно описать как одновременные инверсию, дупликацию и делецию. Если происходят разрывы в двух разных хромосомах, это может привести к неправильному соединению образовавшихся фрагментов и обмену участками — транслокации.
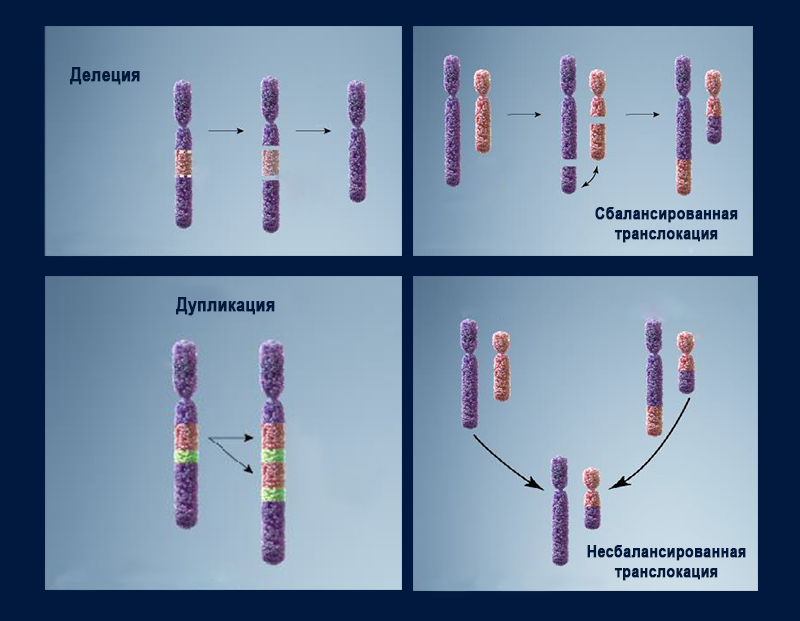
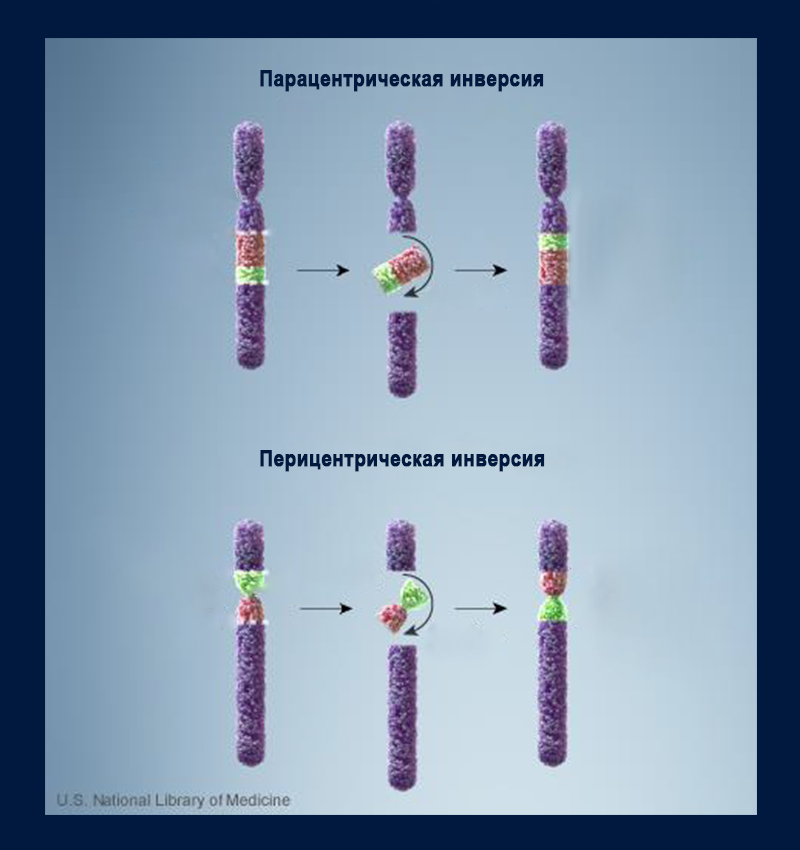
Большинство структурных аберраций возникают в результате неравного обмена между хромосомами или неправильного ферментативного восстановления двух хромосомных разрывов.
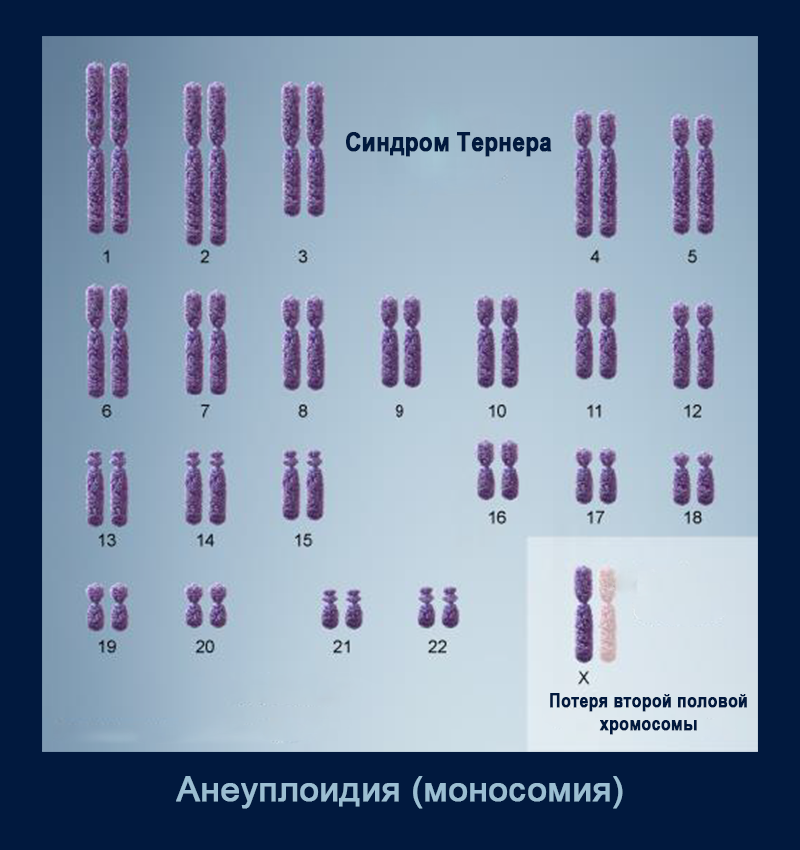
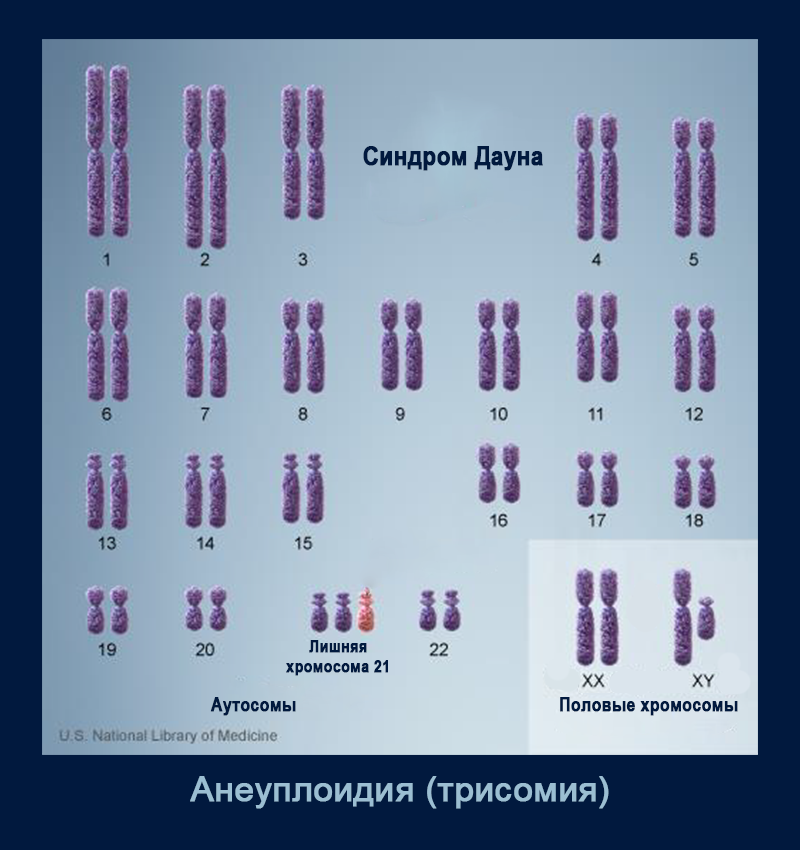
Самая частая хромосомная аномалия у человека — та или иная форма анеуплоидии. Большая часть анеуплоидий заканчивается гибелью эмбриона, но есть и исключения, такие как трисомия по хромосоме 21 (синдром Дауна); трисомия по хромосоме 18 (синдром Эдвардса); трисомия по хромосоме 13 (синдром Патау). К изменениям числа половых хромосом относятся синдром Клайнфельтера (47, XXY; 48, XXXY; 49, XXXXY и др.), синдром тройной Х-хромосомы (47, XXX), синдром XYY (47, XYY), синдром Тернера (45, X, а также иные, более редкие случаи). Анеуплоидии сопровождаются нарушениями развития и когнитивными аномалиями разной степени тяжести.
Полиплоидии — состояния, при которых в клетке находится больше двух наборов хромосом, — встречаются реже, но все они летальны.
Среди транслокаций — состояний, вызванных межхромосомным обменом участками — различают реципрокные транслокации (обмен фрагментами между двумя негомологичными хромосомами) и робертсоновские транслокации. В последнем случае две акроцентрические (с центромерой почти у конца и очень маленьким плечом) хромосомы теряют свои короткие p-плечи и создают новую одиночную хромосому, содержащую одну центромеру и q-плечи обеих исходных хромосом. У таких людей 45 хромосом. Но поскольку в коротких плечах акроцентрических хромосом присутствует лишь небольшое количество генетического материала, их потеря не летальна. У человека хромосомы 13, 14, 15, 21 и 22 являются акроцентрическими, и описаны все возможные варианты робертсоновских транслокаций с их участием.
Некоторые люди с реципрокной или робертсоновской транслокацией могут иметь нормальный фенотип, но у них возникают проблемы с фертильностью и (или) рождаются дети с хромосомными аномалиями.
В результате делеций, дупликаций, несбалансированных транслокаций и инверсий — любой аномалии, которая приводит к потере или приобретению дополнительных копий участков ДНК — возникают вариации числа копий генов (copy number variation, CNV). Некоторые CNV являются доброкачественными, но значительное их число приводит к развитию тяжелых заболеваний, включая аномалии развития, нейропсихиатрические расстройства, рак, иммунодефициты.
Аномалии могут присутствовать не во всех клетках плода, а лишь в части. Это явление называется мозаицизмом, от него часто зависит тяжесть симптомов. В то же время, если доля клеток с аномалиями невелика, возможны ложноотрицательные результаты диагностики.
Стоит ли волноваться из-за этого родителям, которые практически здоровы?
Потери беременности происходят намного чаще, чем считает большинство неспециалистов. Во всем мире ежегодно случается 23 миллиона спонтанных прерываний беременности. Среди клинически распознанных беременностей 10–15% завершаются спонтанным абортом. Часто потеря беременности происходит до 8–9 недель гестации, при этом на ранних сроках женщина даже не знает, что была беременна. Около 60% репродуктивных потерь происходят до имплантации и в первые недели гестации, и лишь около 25% случаев оплодотворения яйцеклетки заканчиваются рождением ребенка.
Факторы риска выкидыша включают очень молодой или зрелый возраст женщины (моложе 20 лет и старше 35 лет), зрелый возраст мужчины (старше 40 лет), предыдущие выкидыши, а также очень низкий или очень высокий индекс массы тела, курение, алкоголь, стресс, работу в ночные смены.
Около 10,8% женщин переживают по крайней мере одну потерю беременности, а 1,9% и 0,7% — две или три потери беременности соответственно.
Определение причины выкидыша крайне важно для планирования последующих беременностей. Повторяющиеся выкидыши могут иметь общую причину. И как уже говорилось, хромосомные аномалии лидируют среди причин по частоте.
Какие существуют методы выявления хромосомных аномалий?
Кариотипирование
Клетки культивируют в специальной среде, с помощью колхицина останавливают расхождение хромосом и подготавливают препарат для микроскопии. Визуально выявить хромосомные аномалии помогают специальные методы окрашивания препарата. Часто используется окрашивание по Романовскому — Гимзе, оно же G-окрашивание или G-бэндинг (1970-е гг.). При этом на хромосомах появляются чередующиеся темные и светлые участки, и их расположение в норме постоянно для каждой хромосомы, так как определяется последовательностью ДНК. (Участки, богатые буквами-нуклеотидами А и С, — более темные, а богатые G и C — более светлые). Существуют и другие методы окрашивания хромосом.
Полученный таким образом препарат фотографируют и «вырезают» хромосомы из микрофотографий, формируя нумерованный набор пар гомологичных хромосом (визуальное представление кариотипа). Для анализа изображений сегодня применяют специальные программные инструменты. Расположение полос позволяет опознать каждую хромосому в клетке, понять, какие из них отсутствуют или представлены лишними копиями, а также увидеть достаточно крупные хромосомные перестройки.
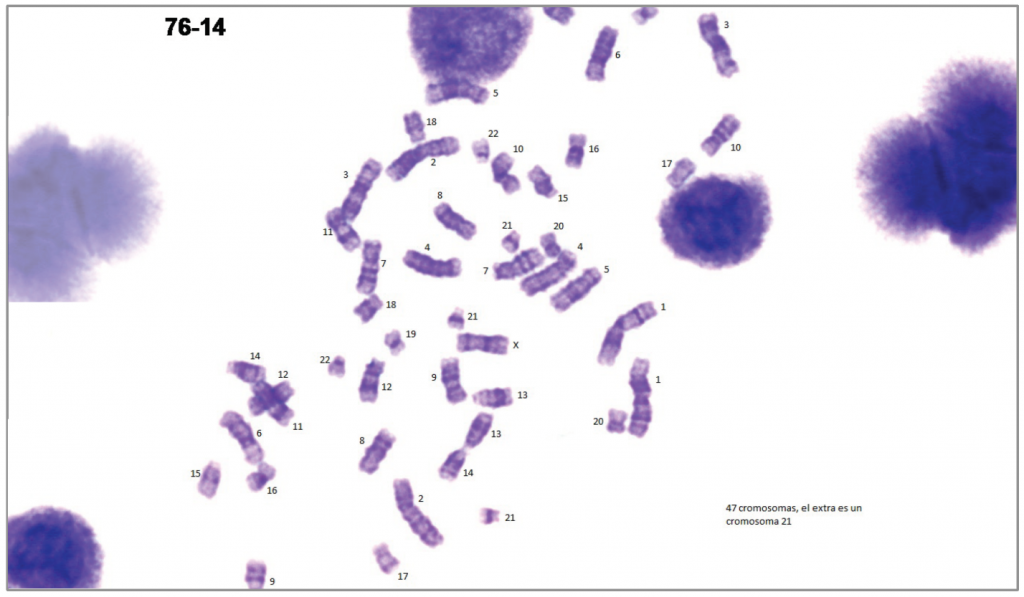 Трисомия по хромосоме 21 (синдром Дауна). Appl. Sci. 2020, 10(8), 2758; DOI:
10.3390/app10082758 |
CC BY 4.0
Трисомия по хромосоме 21 (синдром Дауна). Appl. Sci. 2020, 10(8), 2758; DOI:
10.3390/app10082758 |
CC BY 4.0
Это относительно недорогой метод, но он занимает много времени, так как требует культивирования клеток. Несмотря на программную поддержку, результат зависит от квалификации лаборанта. Для анализа обязательно нужны живые клетки, способные делиться, иначе хромосомы не будут видны. Разрешающая способность метода относительно невысока (до 10 Мб)
Флуоресцентная in situ гибридизация (FISH)
FISH-анализ микроскопических изображений, разработанный в 1980-е годы, основан на гибридизации зондов — коротких молекул ДНК, несущих флуоресцентные метки, — с комплементарными участками ДНК или РНК в препарате. Для кариотипирования с помощью FISH используются ДНК-зонды, которые располагаются вдоль каждой хромосомы. Смеси зондов с метками разного цвета облегчают обнаружение структурных перестроек. (Примеры визуализации хромосом с помощью SKY — «спектрального кариотипирования», варианта FISH с десятками зондов, которые окрашивают хромосомы во все цвета радуги — можно посмотреть здесь.)
Достоинства FISH-анализа — высокая разрешающая способность (100–300 Kб), относительная простота выполнения, объективность и воспроизводимость, а также возможность проведения анализа на культурах клеток с низкой митотической активностью, даже на фиксированных клетках и тканях. Недостатки — зависимость от специфичности ДНК-зондов и более высокая себестоимость, чем у «классического» кариотипирования.
Сравнительная геномная гибридизация (CGH)
Широко применяется с 1990-х. Благодаря проекту «Геном человека» появилась возможность создавать библиотеки коротких клонированных фрагментов ДНК из различных участков генома, одинаковые у подавляющего большинства людей, а это открыло путь к сравнительной геномной гибридизации на чипах (aCGH, также известная как хромосомный микроматричный анализ, или ХМА).
В основе этого метода лежит конкурентная флуоресцентная in situ гибридизация. ДНК пациента и эталонный образец — ДНК здорового человека с нормальным кариотипом — гибридизуются с зондами, иммобилизованы на микрочипе. Фрагменты исследуемой и эталонной ДНК несут флуоресцентные метки, обычно красную и зеленую.
Если у пациента имеется хромосомная аномалия, соотношение фрагментов с зеленой или красной меткой, гибридизующихся с теми зондами, которые соответствуют дуплицированному или делетированному участку, будет отклоняться от 1:1. Соответственно изменится флуоресцентный сигнал, и это изменение можно регистрировать автоматически. Если же у пациента нет аномалий, то все участки генома будут представлены в том же количестве, что участки эталонного генома, и сигнал во всех точках на чипе будет одинаковым.
Разрешающая способность метода выше, чем у FISH (30–110 т.п. н.) Ограничения — невозможность выявлять незначительные по длине вариации числа копий, сбалансированные структурные аномалии (транслокации, инверсии). Он также не выявляет точечные мутации и низкоуровневый мозаицизм (хромосомные аномалии в части клеток исследуемого материала. Кроме того, для анализа требуются большие количества ДНК.
Существует также хромосомный микроматричный анализ на основе SNP-микрочипов (SNP — однонуклеотидные полиморфизмы). Среди его преимуществ перед aCGH — возможность выявлять потерю гетерозиготности и триплоидию. С примером применения этого подхода российскими исследователями можно ознакомиться здесь.
Чем отличается подход CNV-seq?
В этом случае CNV выявляют не с помощью гибридизации, а с помощью высокопроизводительного секвенирования. Этот подход впервые описали в 2009 году Чао Си и Марти Тамми (Национальный университет Сингапура, Каролинский институт, Швеция).
При анализе хромосомных аномалий с помощью CNV-seq сравнивается не интенсивность флуоресцентного сигнала в определенной точке микрочипа, а число прочтений (ридов), то есть покрытие каждого участка, для эталонного и исследуемого генома. Очевидно, что этот показатель зависит от копийности участка — ридов будет меньше, если участок отсутствует, и больше, если присутствует лишняя копия. Использование эталонного генома и специальные статистические методы обработки данных позволяют избежать ложноположительных сигналов из-за неравномерного покрытия генома при секвенировании.
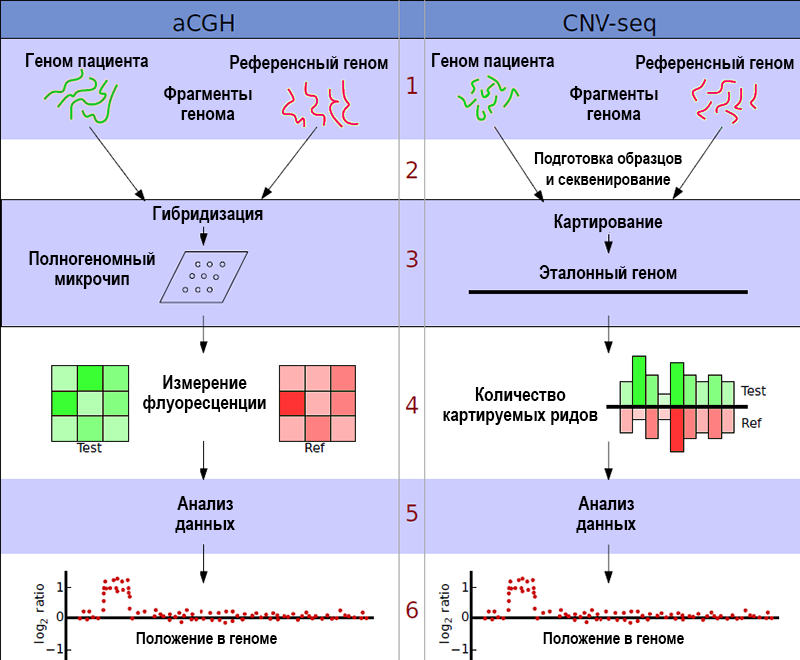 Сравнение принципов методов aCGH и CNV-seq. Credit: Xie, C., Tammi, M.T. BMC Bioinformatics (2009). DOI:
10.1186/1471-2105-10-80
Сравнение принципов методов aCGH и CNV-seq. Credit: Xie, C., Tammi, M.T. BMC Bioinformatics (2009). DOI:
10.1186/1471-2105-10-80
Интересно, что в работе 2009 года Чао Си и Марти Тамми с помощью своего метода выявили вариации числа копий (небольшие и доброкачественные) у двух знаменитых ученых, геномы которых к тому времени были секвенированы, — Джеймса Уотсона и Крейга Вентера. Результаты сравнили с исследованиями CNV, проведенными другими методами; расхождения были, но в целом новый подход показал себя достойно.
Преимущество CNV-seq — возможность работать с небольшими количествами ДНК (10–50 нг; если исследуется кровь, то достаточно 6 мл), при этом подготовка библиотек не требует амплификации ДНК, которая могла бы вызвать отклонения. Метод успешно выявляет хромосомные аномалии даже при низкоуровневом мозаицизме (менее 10% аномальных клеток). Результат для тех или иных участков не зависит от покрытия зондами. Кроме того, он может проводиться одновременно с неинвазивным пренатальным скринингом, что сокращает время для получения результата. Это немаловажный фактор, если пациентка беременна в настоящий момент.
Проводилось ли сравнение CNV-seq с другими методами?
Да, и было показано, что методы, использующие CNV-seq, выявляют аномалии, пропущенные при цитогенетическом анализе или ХМА.
Что такое «Хромосомное секвенирование VISTA™» от BGI Genomics?
«Хромосомное секвенирование VISTA™» (VISTA™ Chromosome Sequencing) — тест, основанный на CNV-seq. Он использует полногеномное секвенирование с низким покрытием для выявления хромосомных аномалий до или во время беременности. С помощью этого теста можно обнаружить широкий спектр аномалий всех соматических и половых хромосом.
Технологию высокопроизводительного секвенирования дополняет анализ коротких тандемных повторов (STR), который повсеместно применяется для ДНК-идентификации человека. В данном случае STR-анализ позволяет удостовериться, что образцы не перепутаны и не загрязнены ДНК другого индивида, а также служит дополнительной мерой контроля качества. Таким образом, он помогает выявить проблемы с образцами, которые могут повлиять на точность тестирования.
Биоинформатический анализ результатов секвенирования включает в себя обработку исходных данных, распознавание потенциальных CNV (участков с аномальной глубиной покрытия) и оценку их клинической значимости. Результаты визуализируются и представляются пользователю (исследователю или клиницисту) в графической форме.
Кому рекомендован этот тест?
Он может быть назначен в следующих случаях:
-
Если были получены аномальные результаты скрининга, включая НИПТ.
-
Если раньше неоднократно происходили выкидыши и (или) рождались дети с генетически обусловленными состояниями.
-
При аномальных результатах УЗИ, если сравнительная геномная гибридизация или анализ SNP не выявили причин.
-
Парам, принадлежащим к популяции с повышенным риском хромосомных аномалий.
- Парам, у которых есть хромосомные аномалии или подозрение на хромосомные аномалии.
-
Матерям старше 35 лет.
Существуют два варианта продукта:
«Хромосомное секвенирование VISTA™-1М» выявляет анеуплоидии всех хромосом и протяженные делеции и дупликации (более 1 млн п.н.). Этот вариант тестирования рекомендован при наличии в анамнезе самопроизвольного прерывания беременности на сроках до 12 недель.
«Хромосомное секвенирование VISTA™-100K» «видит» не только анеуплоидии и протяженные делеции и дупликации, но и более короткие (от 100 тыс. п.н.). Подобный тест может быть назначен также при попадании в группу высокого риска по результатам НИПТ (и других скрининговых тестов первого триместра), при аномальных результатах УЗИ или кариотипирования, или если у родителей есть хромосомные нарушения либо подозрения на хромосомные нарушения.
Этот подход давно применяется в клинике?
На сегодняшний день компания BGI обработала более 170 000 образцов и выявила более 50 000 положительных случаев.
Например, у пациентки 25 лет заподозрили анофтальмию плода (срок: 24 недели и 6 дней). На 25-й неделе беременности у нее отобрали образец пуповинной крови. Тест «Хромосомное секвенирование VISTA™-100K» выявил делецию размером 0,5 млн.п.н. на хромосоме 3. Она ассоциирована с анофтальмией или микрофтальмией (отсутствием или замедлением развития глазного яблока) из-за нарушения работы гена SOX2.
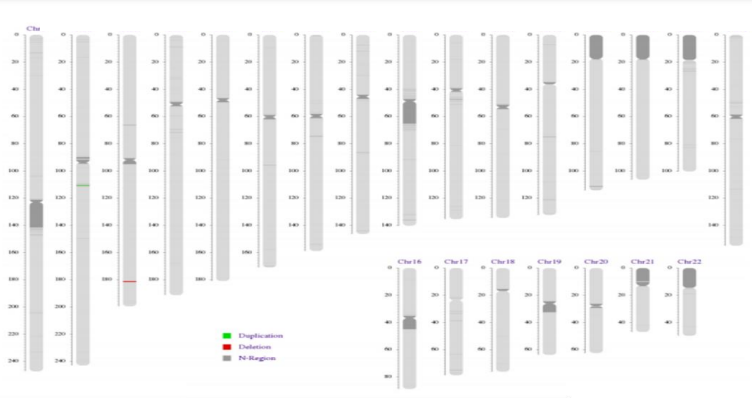
Какие типы образцов могут быть исследованы и сколько времени занимает анализ?
«Хромосомное секвенирование VISTA™» подходит для анализа ДНК из тканей абортивного материала, околоплодных вод, пуповинной крови, периферийной крови новорожденного или взрослого. Время от получения образца до результата — не более 21 дня. Сама процедура анализа занимает около 7 дней.
Есть ли у этого подхода ограничения?
Секвенирование с низким покрытием не позволяет обнаружить хромосомы с высокой частотой дупликаций или пикнозы — аномалии вблизи центромеры или теломерных участков, в том числе робертсоновские транслокации.
Невозможно обнаружить полиплоидию, транслокации и инверсии, а также аномалии размером менее 100 тыс. п.н. или химерные гены с низким процентом мозаицизма. Тест также не выявляет потерю гетерозиготности.
Тестированию не подлежат пациенты после аллогенного переливания крови или трансплантации органов.
Доступно ли «Хромосомное секвенирование VISTA™» для российских пациентов?
Компания BGI Genomics в настоящее время организует трансфер технологии CNV-seq в Россию, чтобы «приблизить» ее к клиентам. При этом образцы и данные будут оставаться в стране.
Трансфер технологии начинается с подготовки лаборатории, персонала и расходных материалов. Затем следуют инсталляция оборудования и валидация технологии, после этого обучение персонала в лаборатории и, наконец, организация сервисного обслуживания. Такой подход гарантирует сохранение высокого качества тестирования.
По всем вопросам о тесте «Хромосомное секвенирование VISTA™» обращайтесь в BGI Genomics.
Как организован трансфер технологий в
BGI Genomics
(*видеоролик на английском языке)
Реклама. Рекламодатель ООО "БИДЖИАЙ РУС" ИНН 9727023261


 Меню
Меню





 Все темы
Все темы
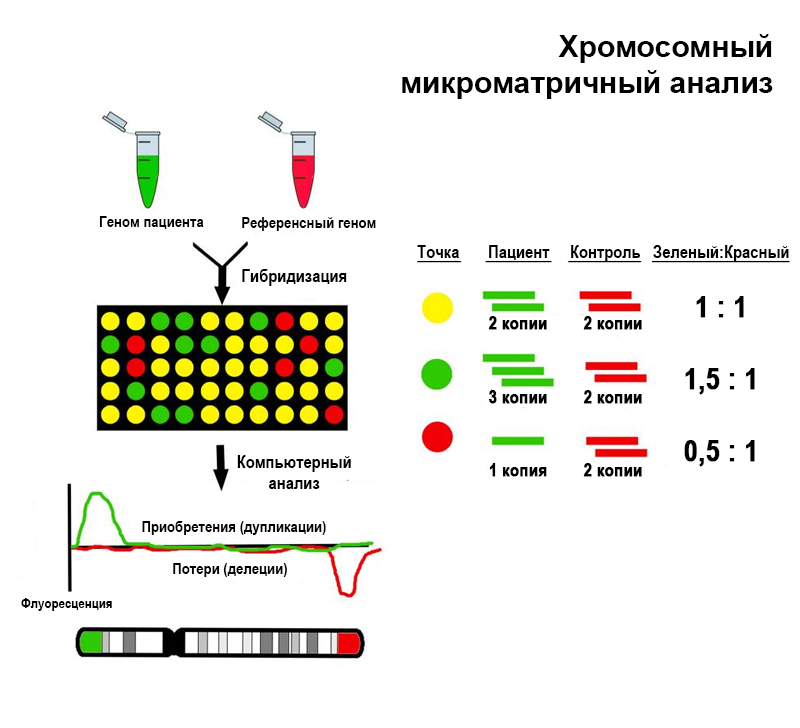 Принцип метода ХМА (aCGH). J Clin Med. 2014. DOI:
Принцип метода ХМА (aCGH). J Clin Med. 2014. DOI:




 0
0








