Нобелевская неделя 2023. Каталин Карико: «Я случайно узнала о существовании BioNTech от других ученых, которые тоже были уволены из лабораторий»
«Матричная РНК была открыта в 1961 году, но прошло еще 60 лет до того момента, как первая мРНК-вакцина была одобрена FDA». — Лекция лауреата Нобелевской премии по физиологии или медицине 2023 года Каталин Карико.

«Гости, коллеги, студенты, исследователи — я очень рада быть здесь. Я никогда прежде не читала лекцию для такой огромной аудитории, — сказала доктор Карико. — В следующие 45 минут я “разогрею” вас перед лекцией Дрю Вайсмана и расскажу о разработке матричной РНК для терапии».
Матричная РНК была открыта в 1961 году, но прошло еще 60 лет, прежде чем первая мРНК-вакцина получила одобрение FDA. Доктор Карико рассказала, как изучалась матричная РНК на протяжении этого времени. По ее оценке, знаковые события происходили в среднем каждые 20 лет.
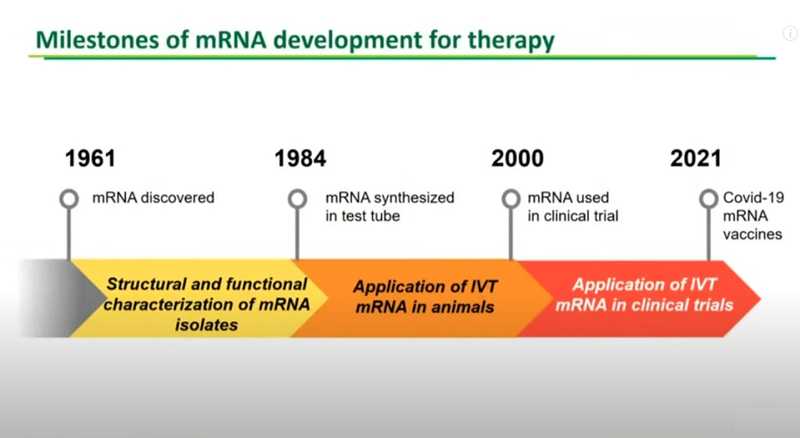
После открытия в 1961 году ученые не могли синтезировать РНК — ее можно было только изолировать и описывать ее функциональные свойства. Были идентифицированы такие важные элементы РНК, как поли(А)-хвост и кэп, которые обеспечивают стабильность молекулы и критически важны для процесса трансляции. Удалось осуществить доставку изолированных молекул мРНК в липидной оболочке в клетки млекопитающих.
В 1984 году Дуглас Мелтон и его коллеги открыли эффективный способ синтезировать мРНК «в пробирке» с помощью плазмиды и короткого промотора. Позже мРНК, кодирующую человеческий бета-интерферон, ввели в ооциты лягушки и впервые получили функционально активный бета интерферон с искусственно синтезированной мРНК.
Ученые всего мира начали использовать синтезированную мРНК в своих исследования. Одни сосредоточились на терапевтических приложениях мРНК, например, для лечения гипертензии, сахарного диабета. Другие проверяли, можно ли сделать на основе мРНК вакцины от гриппа или рака. «Но если вы попробуете проследить за работой кого-то из этих ученых, вы поймете, что никто из них не продолжал публиковать результаты исследований мРНК». Проблема в небольшом количестве белка, который синтезируется из мРНК, его лабильности и быстрой деградации. С такой мРНК не получить грант на исследование, говорили коллеги Карико.
Примерно в это же время, в 1989 году, доктор Карико начала работу в Пенсильванском университете под руководством кардиолога Элиота Барнатана, который занимался изучением рецептора урокиназы (uPAR). Этот рецептор имеет большое количество посттрансляционных модификаций, которые и делают его функционально активным.
«Я клонировала урокиназный рецептор, создала мРНК, мы ввели ее в клетки млекопитающих. Мы увидели рецептор на поверхности клеток, и он был функционально активный. Это был момент, когда мы осознали, что мРНК могут использоваться для терапии».
К сожалению, доктор Карико не смогла продолжить эти исследования, так как не удалось получить грант. Она начала работать с Дэвидом Лангером, ныне известным нейрохирургом, который в то время был ординатором в Пенсильванском университете. «Я проработала там 17 лет. Поскольку я не получила финансирование, эксперименты проводила самостоятельно: готовила гель для электрофореза, культивировала бактерии, изолировала плазмиды и, конечно, размораживала холодильник по расписанию», — рассказывает Каталин Карико. Лангер и Карико работали над мРНК-терапией для лечения пациентов с инсультом.
В 1997 году Карико познакомилась с Дрю Вайсманом, который разрабатывал вакцину от ВИЧ. «Говорят, что мы с Дрю боролись, соревновались, но это неправда, это выдуманная история. Мы были в дружеских отношениях и были рады работать вместе».
Проведя серию совместных экспериментов, они обнаружили, что мРНК, введенная в дендритные клетки, приводит к воспалительному иммунному ответу и продуцирует фактор некроза опухоли. «Дрю не беспокоился по этому поводу, в отличие от меня. Я хотела разработать мРНК для лечения инсульта. Но ФНО, который вызывает воспалительный ответ, — не та молекула, которую я хотела бы ввести пациентам».
После этого ученые поставили себе задачу понять, почему мРНК вызывает иммунный ответ. Они изолировали мРНК из различных компартментов клетки, чтобы изучить воспалительный ответ после введения в дендритные клетки. мРНК, синтезированная доктором Карико в пробирке, вызывала более сильную продукцию ФНО, чем изолированные РНК из клеток млекопитающих. Особенно отличалась транспортная РНК — она вызывала самый слабый ФНО-ответ.
Ученые заметили, что транспортная РНК обогащена нуклеотидными модификациями и решили проверить гипотезу, согласно которой большее количество модификаций коррелирует со снижением воспалительного ответа. Но какие именно модификации нужно внести в мРНК, оставалось под вопросом: «Существует более ста вариантов модификаций РНК, которые происходят благодаря ферментам. Но проблема в том, что эти ферменты неизвестны».
Карико решила пойти другим путем и использовать нуклеозиды, которые уже модифицированы и широко встречаются в клетках человека. Оставалось надеяться, что РНК-полимераза сможет их использовать. В итоге из 10 выбранных нуклеозидов пять подошли для синтеза. Полученную мРНК с модифицированными основаниями ввели в человеческие дендритные клетки, и оказалось, что часть мРНК по-прежнему провоцирует воспалительный ответ и производство ФНО, а часть нет. Карико обнаружила, что иммунный ответ не провоцирует мРНК с модифицированным уридином, который часто встречается в организме человека, например, с псевдоуридином, 5-метилуридином или 2-тиоуридином. «Как-то природа выбрала уридин, чтобы распознавать РНК, попавшую извне, и провоцировать иммунную систему».
Карико и Вайссман продолжили исследовать модификации уридина. «Мы были воодушевлены, очевидно, что мы оба хотели бы иметь мРНК, которая продуцирует протеин. Поэтому мы вернулись к экспериментам». Выяснилось, что мРНК, содержащая псевдоуридин, транслируется намного эффективнее, чем мРНК с другими типами модификаций. Псевдоуридиновая мРНК, содержащая ген липофектина, вызвала синтез белка в культивируемых нейронах.
Затем тестировали мРНК in vivo, и даже у животных мРНК с псевдоуридином транслировалась лучше, давая больший выход белкаа и не вызывала воспалительный ответ. Оказалось, что мРНК без модификаций активирует РНК-зависимую протеинкиназу, поэтому производство белка было меньше, чем при наличии модификаций в мРНК. Также ученые обнаружили, почему РНК с уридином быстро деградирует, а с псевдоуридином остается стабильной.
Однако Карико и ее коллеги были обеспокоены результатами эксперимента на клеточной линии с гиперэкспрессией Толл-подобного рецептора 3. Этот рецептор связывает двухцепочечную РНК, также он ингибирует трансляцию. «Мы заподозрили, что наша синтезированная РНК, вероятно, содержит двухцепочечную РНК. Когда мы нашли специфические антитела против двухцепочечной РНК, догадка подтвердилась. (…) Вы не представляете, как много времени мы потратили на то, чтобы понять, как очистить РНК. Как ученые, мы всегда сталкиваемся с чем-то, чего никто прежде не делал, но нам приходится. Мы не знали, получится ли, но надеялись, что сможем очистить РНК».
С помощью высокоэффективной жидкостной хроматографии от двухцепочечной РНК удалось издавиться. Дело в том, что синтезированная мРНК с псевдоуридином индуцировала выработку цитокинов дендритными клетками, хоть и в меньшем количестве. Но после очистки от двухцепочечной РНК, к радости исследователей, синтеза цитокинов не было совсем. Удивительным оказалось также, что трансляция очищенной методом ВЭЖХ РНК, которую тестировали в различных типах клеток, оказалась примерно в тысячу раз более эффективной. «Со всеми улучшениями метода вместо мизерного количества быстро деградирующего белка, мы получили много стабильного белка».
После этого Карико с коллегами продолжили эксперименты in vivo. Они создали мРНК, кодирующую ген эритропоэтина, и ввели ее животным. Эритропоэтин стимулирует выработку эритроцитов, поэтому увеличивает их число и, как следствие, гематокрит. Белок имеет короткое время стабильности, обнаруживается в крови всего в течение 2-6 часов и затем разрушается. Когда мышам вводили мРНК с обычным уридином, кодирующую эритропоэтин, белок исчезал из кровотока очень быстро. Если же вводили мРНК с модифицированным уридином (псевдоуридином) — эритропоэтин обнаруживался даже через четыре дня и был функционально активным. Введение такой мРНК каждую неделю увеличивало гематокрит на протяжении семи дней. Что более важно, в этом эксперименте очищенная мРНК с псевдоуридином не провоцировала воспалительный ответ. Результаты серии этих экспериментов были опубликованы в 2012 году.
В этом же году Карико снова потеряла научную должность в институте, что привело ее в компанию BioNTech: «Я случайно узнала о существовании BioNTech от других ученых, которые тоже были уволены из лабораторий». Карико рассказала, что попала в дружелюбную команду профессионалов и энтузиастов, вместе с которыми стала работать над созданием мРНК лекарств.
Один из проектов, в котором она принимала участие, посвящен созданию мРНК, кодирующей биспецифические антитела для лечения опухолей. мРНК вводили животным с опухолью, и вырабатываемые антитела связывали одновременно Т-клетки и специфические антигены опухолевой клетки, что приводило к ее уничтожению. Препарат дошел до стадии клинических исследований. В другом проекте разрабатывалась мРНК, кодирующая цитокины: ее вводили животным с меланомой, чтобы вызвать переход «холодной» опухоли в «горячую». Иммунные клетки обучались распознавать опухолевые клетки и ликвидировали клетки метастазов. Препарат также находится на стадии клинических испытаний.
«Вы можете спросить меня, почему белковые препараты на основе мРНК так важны, — говорит доктор Карико. — Я отвечу: количество лекарств, основанных на белках, стремительно растет. Сто лет назад белок впервые стал лекарством — это был инсулин. В 1982 году впервые был представлен рекомбинантный белок — снова инсулин, продуцируемый бактериальными клетками. Есть много других рекомбинантных терапевтических белков, они очень эффективны, но проблема в том, что их производство очень дорогое, и нужно понять, как сделать их доступными».
Среди преимуществ мРНК нобелевская лауреатка выделила отсутствие необходимости очистки белка, скорость и дешевизну разработки мРНК, верную структуру белка, который транслируется в клетке с РНК-матрицы, а также возможность совмещать несколько белков в одной мРНК.
В заключение Каталин Карико поблагодарила своих коллег. Особую благодарность она выразила Дрю Вайсману, с которым работала десятилетиями, а также сотрудникам Университета Пенсильвании и Темпла, компании BioNTech.


 Меню
Меню





 Все темы
Все темы




 0
0







