Топ-5 современных методик выделения нуклеиновых кислот
Практически все научные исследования в области молекулярной биологии на той или иной стадии включают этап выделения нуклеиновых кислот. Выделенные нуклеиновые кислоты затем используют в ПЦР (ОТ-ПЦР), секвенировании и для множества других задач, причем технологии выделения различаются не только по принципу своего действия, но и в зависимости от типа биоматериала и последующего применения экстракта.

Впервые нуклеиновые кислоты пытались выделить в середине XIX века, когда ещё практически ничего не было известно об этих молекулах. Однако с момента открытия структуры и свойств ДНК технологии её выделения непрерывно модифицируются и совершенствуются. В данной статье рассматриваются самые распространенные и прогрессивные методики, используемые для экстракции нуклеиновых кислот.
Выделение фенол-хлороформом
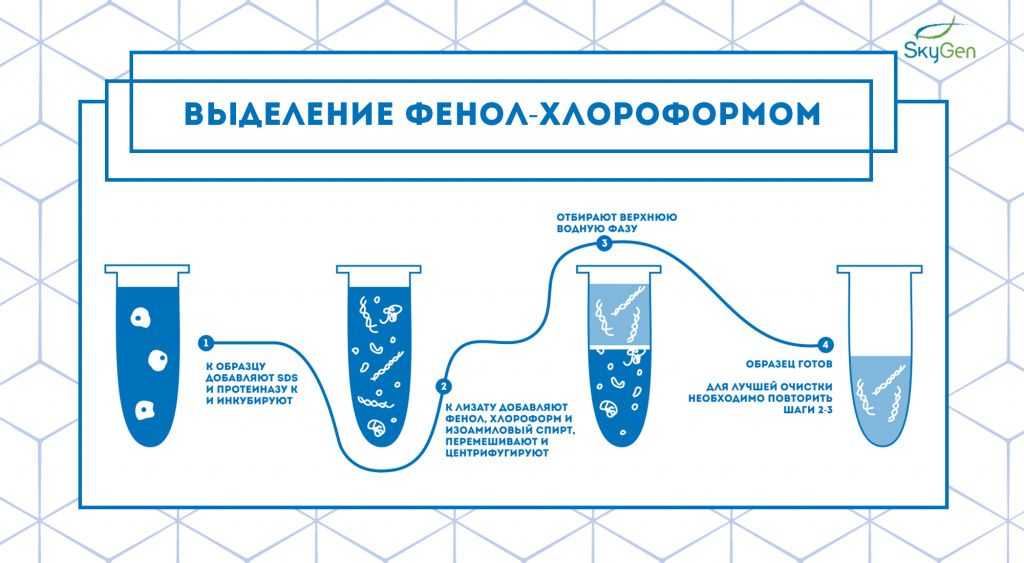 Рис.1. Схема протокола выделения фенол-хлороформным методом.
Рис.1. Схема протокола выделения фенол-хлороформным методом.
Первое упоминание об использовании этого метода встречается в статье 1967 года 1, и с тех пор эта технология является одним из самых распространённых способов выделения нуклеиновых кислот.
Суть методики заключается в смешивании клеточного лизата с фенолом, хлороформом и изоамиловым спиртом в пропорции 25:24:1 и последующем перемешивании и центрифугировании смеси. После проведения этих манипуляций получается раствор с двумя фазами: водной и органической, причем все липиды и жиры находятся в органической (нижней) фазе, белки — на границе фаз, а нуклеиновые кислоты — в водной (верхней) фазе 2 (Рис.1). Для повышения чистоты экстракта эти действия повторяют несколько раз. Если раствор будет иметь низкий pH, то ДНК перейдёт в органическую фазу, а РНК останется в водной фазе, что позволяет выделять РНК отдельно от ДНК.
Данный метод используется повсеместно, поскольку он не требует дополнительного сложного оборудования и имеет невысокую стоимость. Однако нуклеиновые кислоты, полученные таким образом, обладают невысоким качеством и зачастую требуют дополнительной очистки. Также эта технология имеет существенно меньший выход нуклеиновых кислот в сравнении с другими методиками.
Помимо качества экстракта, этот метод обладает ещё несколькими недостатками: он требует сложных манипуляций, которые могут привести к контаминации и потере образца, а сам процесс трудно автоматизировать. Также весь протокол занимает достаточно много времени 3.
Выделение на спин-колонках
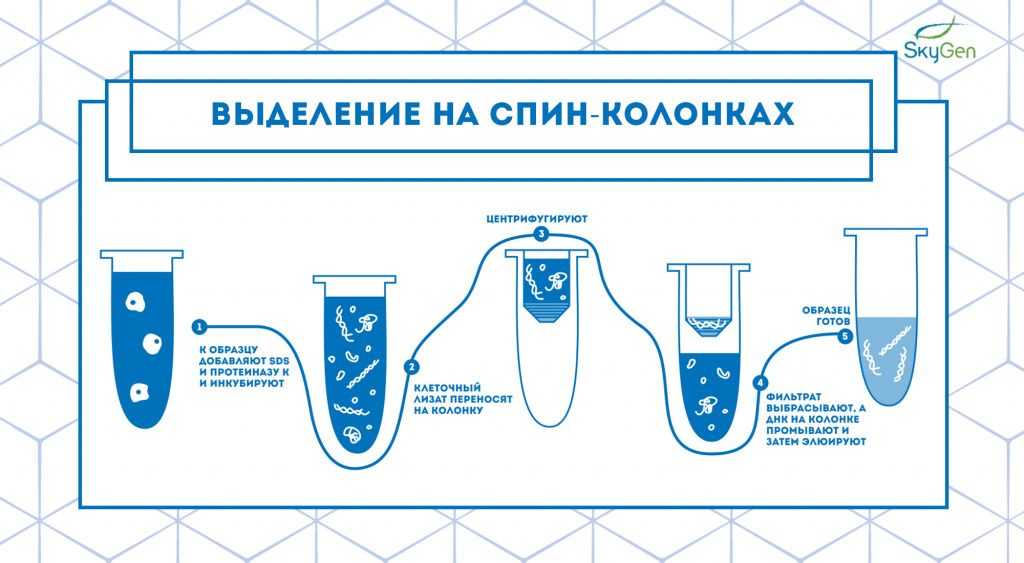
Рис.2. Схема протокола выделения на спин-колонках.
Технология выделения на спин-колонках — это усовершенствованный метод экстракции на частичках силики, предложенный американскими учёными в 1979 году 4. Они продемонстрировали, что в щелочных условиях и при повышенных концентрациях соли ДНК связывается с силикатами, и это позволяет отделить все остальные компоненты клетки от частиц силики со связанной ДНК. Спин-колонки сконструированы таким образом, что при нанесении клеточного лизата на колонку и последующем центрифугировании ДНК остаётся на колонке, а всё лишнее проходит сквозь неё (Рис.2). Затем ДНК промывают несколько раз и элюируют в пробирку для сбора образца.
Преимущества такого метода заключаются в повышенной чистоте и хорошем качестве выделенных нуклеиновых кислот, высокой воспроизводимости и простоте по сравнению с выделением фенол-хлороформом. Однако также большое количество манипуляций может привести к контаминации, а выделение коротких фрагментов ДНК на спин-колонках может быть затруднено 5.
Экстракция на спин-колонках может занять от 20 минут в зависимости от биоматериала и сложности его лизиса.
На рынке этот метод представлен большим разнообразием наборов от таких производителей, как Qiagen, Analytik Jena, NEB, ThermoFisher и других. Стоимость одного выделения здесь значительно выше, чем у предыдущего метода, поскольку на каждую реакцию необходима своя колонка, несколько пробирок для сбора фильтрата и элюата и, конечно, реагенты.
Выделение на магнитных частицах
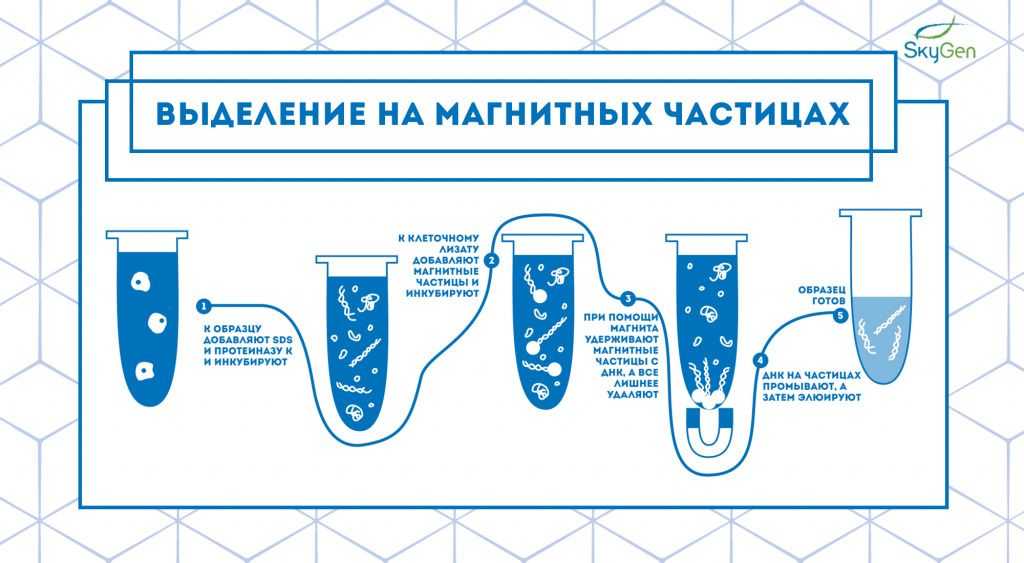
Рис.3. Схема протокола выделения на магнитных частицах.
Спустя 20 лет после появления метода выделения на спин-колонках начинает набирать популярность более быстрый способ выделения на магнитных частицах 6. Технология этого способа выделения основана на связывании нуклеиновой кислоты с веществом, покрывающим магнитные частицы (целлюлоза, сефадекс, сефакрил, dT-олигонуклеотиды, специфичные олигонуклеотиды и др.). К клеточному лизату добавляют такие магнитные частицы и перемешивают для связывания ДНК с ними. После этого пробирку ставят в магнитный штатив или подносят к магниту, фиксируя таким образом твердую фазу. После отбора супернатанта нуклеиновые кислоты на частицах промывают и элюируют 7 (Рис.3).
Этот метод имеет те же преимущества, что и выделение на спин-колонках, но для экстракции на магнитных частицах не требуется сложное лабораторное оборудование (например, центрифуга). Более того, процесс выделения на магнитных частицах легко автоматизировать, и многие автоматические станции выделения основаны именно на этой методике 3. Однако здесь также присутствует риск контаминации и потерь образца.
Данный протокол выделения займет немного меньше времени благодаря отсутствию этапов центрифугирования, но количество манипуляций будет примерно таким же. Также стоимость одной реакции обычно выше, чем при выделении на колонках, а панели наборов предоставляют Qiagen, Analytik Jena, ThermoFisher и другие.
Умное выделение (Smart Extraction)
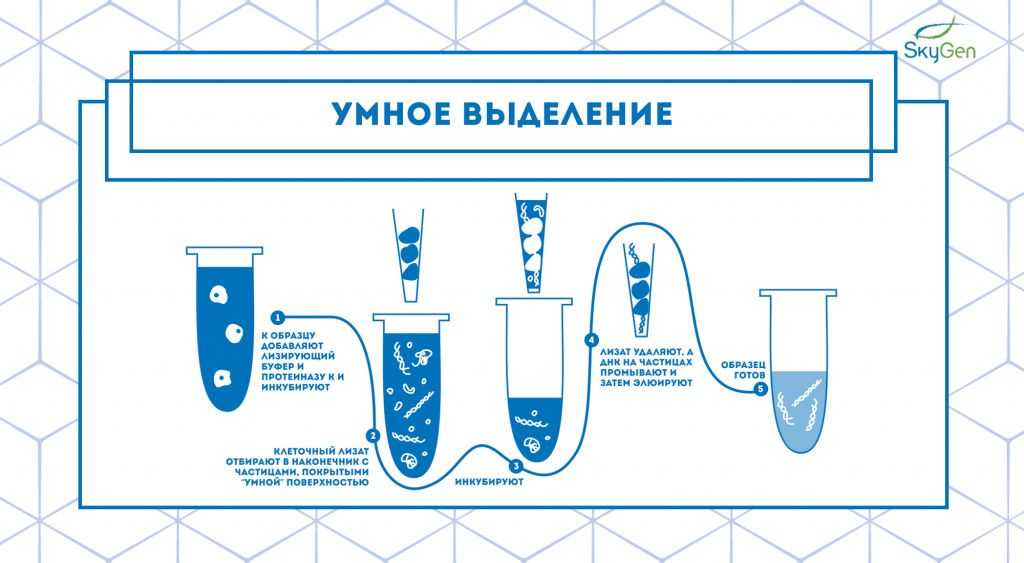 Рис.4. Схема протокола умного выделения. Протокол основан на принципе работы наборов для выделения компании Analytik Jena.
Рис.4. Схема протокола умного выделения. Протокол основан на принципе работы наборов для выделения компании Analytik Jena.
Методики выделения нуклеиновых кислот не перестают совершенствоваться: в 2005 году специалисты из компании Analytik Jena доказали, что для связывания нуклеиновых кислот с неорганической твёрдой фазой можно использовать не только хаотропные соли, но и смесь из хаотропных и нехаотропных солей с низкой ионной силой, эту технологию они назвали Dual Chemistry 8.
Позднее они усовершенствовали технологию Dual Chemistry при помощи немагнитных частиц с «умной» поверхностью 9. Для выделения используются специальные наконечники с этими частицами, которые надеваются на дозатор. При заборе клеточного лизата в наконечник нуклеиновая кислота из раствора связывается с частицами, затем следуют этапы промывки и элюции, в результате чего получается очищенная нуклеиновая кислота высокого качества (Рис.4).
Эта технология значительно ускоряет процесс выделения, а благодаря особенностям «умной» поверхности выход и качество нуклеиновых кислот значительно превосходит все предыдущие методы. Данный способ экстракции очень легко автоматизировать, ведь носики со связывающими частицами подходят как для обычных лабораторных дозаторов, так и для различных автоматических станций выделения нуклеиновых кислот.
Ферментативное температурно-зависимое выделение
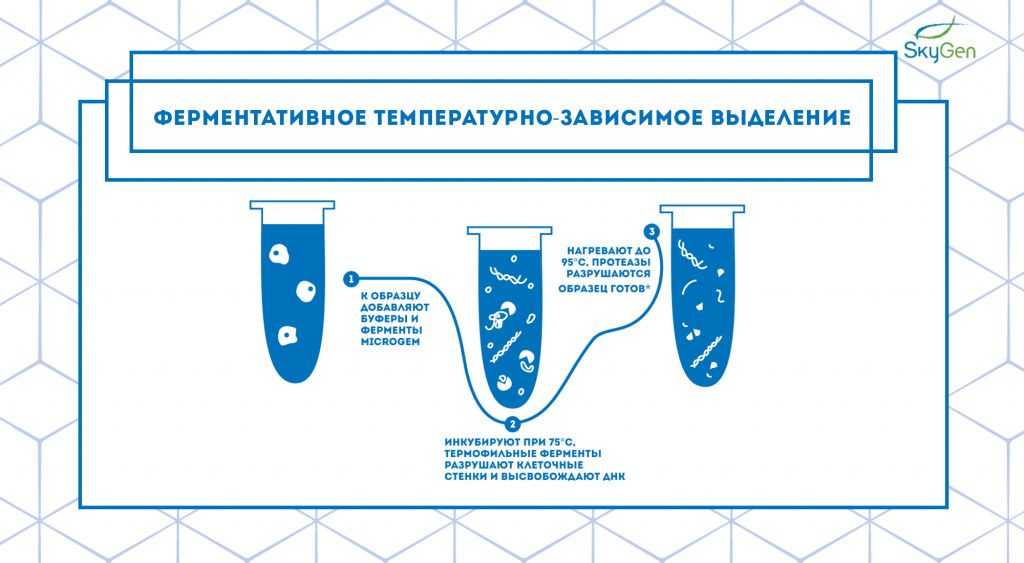
Рис.5. Схема протокола ферментативного температурно-зависимого выделения. Протокол основан на принципе работы наборов для выделения компании MicroGEM. * — несмотря на невысокую степень очистки, образец отлично подходит для дальнейшего использования в ПЦР, секвенировании и STR.
Все вышеперечисленные методики имеют общую лимитирующую стадию — этап лизиса. Во всех технологиях используется SDS и протеиназа K для разрушения клеточных стенок и высвобождения нуклеиновых кислот. SDS является ингибитором ПЦР, именно поэтому необходимы множественные стадии промывки, которые повышают риск контаминации и приводят к потерям образца. Также более сложные для лизиса образцы могут требовать дополнительную долгую и трудозатратную пробоподготовку.
Специалисты из новозеландской компании MicroGEM (ранее известной как ZyGEM) ликвидировали проблемы, связанные с длительным и сложным лизисом и использованием вредных химикатов, благодаря применению очень эффективной термофильной протеиназы EA1 вместе с мезофильными гидролазами 10.
Процесс ферментативного температурно-зависимого выделения начинается со смешивания буфера и ферментов с образцом. При последующей инкубации при комнатной температуре гидролазы деградируют клеточные стенки. После этого пробирку нагревают до 75°C, что активирует работу протеиназы EA1, которая разрушает все белки и высвобождает нуклеиновые кислоты. Последующее нагревание до 95°C дезактивирует EA1, и после этого образец готов для дальнейшего исследования (Рис.5). Для особо загрязненных образцов вроде почвы или растений можно добавить этап очистки на колонке для избавления от ингибиторов.
Данная технология оптимальна для работы с малым количеством биоматериала, поскольку нет потерь нуклеиновых кислот. Также эту методику легко автоматизировать, она самая быстрая среди всех упомянутых способов выделения (от 7 минут) и включает меньше всего манипуляций. Стоимость одной реакции невысока, поскольку кроме реагентов не требуется никаких специальных расходных материалов.
Обзор подготовлен при поддержке компании SkyGen — официального дистрибьютора продукции Analytik Jena, MicroGEM, Qiagen, NEB и других производителей.
Источники
1. Rae, P. M. M., Barnett, T. R. & Babbitt, D. G. Factors influencing the yield of satellite DNA in extractions from Drosophila virilis and Drosophila melanogaster adults and embryos. BBA Sect. Nucleic Acids Protein Synth. (1976) doi:10.1016/0005-2787(76)90157-X.
2. Patrinos, G. P., Danielson, P. B. & Ansorge, W. J. Molecular Diagnostics: Past, Present, and Future. in Molecular Diagnostics: Third Edition (2016). doi:10.1016/B978-0-12-802971-8.00001-8.
3. Ali, N., Rampazzo, R. D. C. P., Costa, A. Di. T. & Krieger, M. A. Current Nucleic Acid Extraction Methods and Their Implications to Point-of-Care Diagnostics. BioMed Research International (2017) doi:10.1155/2017/9306564.
4. Vogelstein, B. & Gillespie, D. Preparative and analytical purification of DNA from agarose. Proc. Natl. Acad. Sci. U. S. A. (1979) doi:10.1073/pnas.76.2.615.
5. Green, M. R. & Sambrook, J. Molecular Cloning, 3-Volume Set : A Laboratory Manual. Cold Spring Harbour Laboratory Press (2012).
6. Trevor Hawkins. DNA PURIFICATION AND ISOLATION USNG MAGNETIC PARTICLES. United States Pat. (#5,705,628 ) 9, 2989–2997 (1998).
7. Tan, S. C. & Yiap, B. C. DNA, RNA, and protein extraction: The past and the present. Journal of Biomedicine and Biotechnology (2009) doi:10.1155/2009/574398.
8. http://www.dual-chemistry.com/
9. https://www.analytik-jena.com/products/kits-assays-reagents/extraction-technology/


 Меню
Меню





 Все темы
Все темы




 0
0