Пять причин узнать больше о резистентности к антибиотикам
В 2017 году Всемирная организация здравоохранения опубликовала список самых опасных бактерий, которым необходимо уделить особое внимание в ближайшее время. Чем же эти создания так напугали ВОЗ? Рассказываем о пяти фигурантах списка.
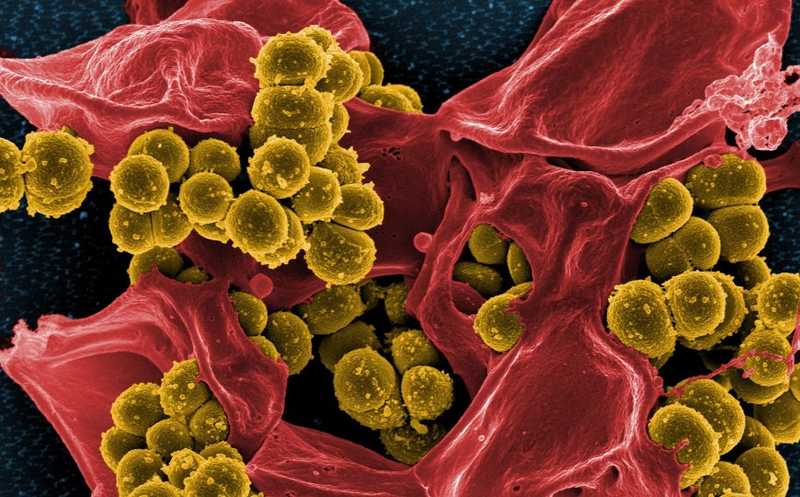
Клетки метициллинрезистентного золотистого стафилококка (желтый) на разрушенном лейкоците человека (красный).
Credit:
NIH | flickr.com
Одним из крупнейших и важных открытий XX века можно считать выделение пенициллина. В 1929 году профессор Александр Флеминг опубликовал статью, в которой описал соединение, способное угнетать рост бактерий на чашке Петри. Однако терапевтическая роль пенициллина в статье упоминалась как возможное применение. Соединение было нестабильно.
В настоящее оружие против бактерий пенициллин был превращен десятилетием позже, в Оксфорде. Команда ученых под руководством Говарда Флори впервые начала выпускать пенициллин в промышленных масштабах и проверила его эффективность на мышах. Уже через три года лекарство нашло своего первого пациента — констебля запаса Альберта Александера, который страдал от ран, полученных при бомбежке, а затем оцарапал лицо шипами розы. Инъекции помогли ему буквально за один день; к сожалению, позднее у этого пациента случился рецидив, и он умер. Препарата было недостаточно для полноценного курса лечения; в то время нехватка драгоценного антибактериального лекарства еще была такой острой, что пенициллин извлекали из мочи и вводили повторно. Однако после этого пенициллин спас тысячи жизней во время Второй мировой войны, а Флеминг, Флори и его сотрудник Эрнст Чейн были удостоены Нобелевской премии.
К сожалению, этой прекрасной истории не суждено было длиться вечно. Уже во время своей работы по производству пенициллина Чейн заметил, что некоторые штаммы E.coli способны противостоять действию антибиотика. Авторы обнаружили, что это возможно благодаря секреции специального белка, который назвали пенициллиназой. Позже, в 1942 году были зафиксированы первые клинические случаи инфекции резистентными бактерий из рода Staphylococcus.
Сегодня антибиотикорезистентность — одна из главных проблем всемирного здравоохранения. В 2017 году ВОЗ опубликовала список, включающий 12 резистентных бактерий, которые представляют наибольшую угрозу для человека.
При составлении авторы учитывали несколько факторов, в том числе насколько смертоносны инфекции, требуют ли они длительного лечения, как часто встречаются устойчивые варианты, при каких обстоятельствах происходит заражение и можно ли его предотвратить (например, с помощью вакцинации или соблюдения правил гигиены), какие варианты лечения еще доступны и есть ли уже в разработке новые антибиотики против данного патогена. Стоит отметить, что туберкулезную палочку в этот список не включили, потому что для нее существуют отдельные программы по борьбе с резистентностью.
Список условно разделен на три группы, в зависимости от того, насколько срочно необходимо решение. В первую группу вошли микроорганизмы с множественной резистентностью, устойчивые в том числе к карбапенемам — в этом случае остается мало вариантов терапии. Во вторую и третью группу попали бактерии-возбудители эпидемиологически наиболее опасных заболеваний, которые все чаще демонстрируют устойчивость. Мы расскажем о первой группе, а также о двух широко известных представителях второй — Staphylococcus aureus и Neisseria gonorrhoeae.
Acinetobacter baumannii
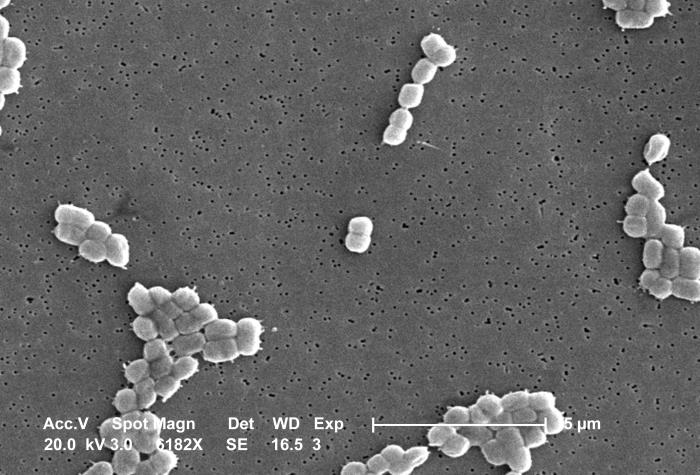 СЭМ-снимок Acinetobacter. Credit:
Public Health Image Library
СЭМ-снимок Acinetobacter. Credit:
Public Health Image Library
История открытия
Впервые представители рода Acinetobacter появляются в статье 1911 года. Первооткрывателем бактерии стал знаменитый нидерландский микробиолог Мартин Бейеринк. Однако свое нынешнее название род получил лишь спустя 43 года. В 1954 Прево и Брису смогли выделить этих бактерий среди других микроорганизмов благодаря их неподвижности и дали им название Acinetobacter (с греческого akinetos — «неподвижный»).
Вид Acinetobacter baumannii был выделен в 1986 году во Франции c помощью метода ДНК-гибридизации и охарактеризован как аэробная грампозитивная палочка. Назвали его в честь американских микробиологов Пола и Линды Бауман. Позже оказалось, что «неподвижная» бактерия все-таки может перемещаться с помощью пилей.
Болезни
A. baumannii — оппортунистический паразит, то есть инфекция обычно не опасна для людей со здоровой иммунной системой. Бактерия известна как возбудитель респираторных заболеваний, инфекций крови, менингита и болезней мочевыводящих путей. Например, A. baumannii вызывает пневмонию, ассоциированную с искусственной вентиляцией легких (ИВЛ). Согласно исследованию 2016 года (то есть это еще ситуация до пандемии COVID-19), около 10% пациентов на ИВЛ заболевают данным подтипом пневмонии. ИВЛ-ассоциированная пневмония лидирует среди причин смертности тяжелобольных людей.
Резистентность
A. baumannii резистентна к большинству бета-лактамов — антибиотиков на основе пенициллина. Она может противостоять карбапенемам, которые считаются одними из самых эффективных бета-лактамных соединений и часто применяются против резистентных микроорганизмов. Резистентность обеспечивают ферменты бета-лактамазы, которые относятся к классу гидролаз. Они разрезают антибиотик и инактивируют его. Кроме того, в геноме бактерии может мутировать белок, который помогает антибиотику попасть внутрь клетки. Например, потеря белка carO приводит к устойчивости против меропенема из класса карбапенемов.
Тем не менее некоторые карбапенемы до сих пор эффективны против A. baumannii. Например, имипенем помогает вылечить от 57 до 83% случаев пневмонии, однако существуют штаммы, резистентные и к нему.
Кроме этого, штаммы A. baumannii могут быть резистентными к тетрациклинам, аминогликозидам, полимиксинам, фторохинолам и макролидам. Устойчивость достигается с помощью модифицирующих антибиотик ферментов (аминогликозиды), мутаций белка-мишени (фторхинолоны, аминогликозиды, тетрациклины) или удаления молекулы лекарства из клетки (аминогликозиды, фторхинолоны, тетрациклины, макролиды).
Pseudomonas aeruginosa (синегнойная палочка)
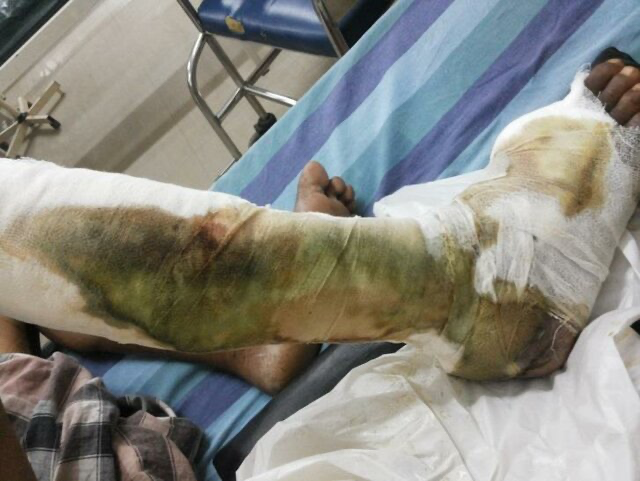 Бинты, заросшие синегнойной палочкой. Credit: ResearchGate
Бинты, заросшие синегнойной палочкой. Credit: ResearchGate
История открытия
Первой встречей синегнойной палочки и научного сообщества можно считать заметку Шарля Седийо, французского военного хирурга, автора книги «О гнойных инфекциях, или пиемии». В 1850 году он обнаружил, что раневая повязка со временем может приобрести синий цвет, и предположил, что это происходит из-за некоего инфекционного агента. Кстати, именно Седийо в начале 1850-х годов, за десятилетие до Игнаца Земмельвейса, связывал послеоперационные инфекционные осложнения с близостью клинических служб к анатомическому кабинету, а позднее ввел в научный обиход слово «микроб».
После этого ученые пытались определить синий пигмент и найти его производителя, однако лишь 32 года спустя Луи-Шарль Жессар смог выделить чистую культуру бактерий из сине-зеленого гноя больных. Позже выяснилось, что синегнойная палочка обитает практически повсюду и может быть изолирована из почвы, с животных и растительных тканей.
Болезни
С инфекционными заболеваниями Pseudomonas aeruginosa связали только в 1916 году. Это сделал ученый Леонард Фримен, который подробно описал, как палочка приводит к острым и хроническим инфекциям.
Сейчас известно, что P. aeruginosa — оппортунистический патоген, то есть, как и A. baumannii, опасный в первую очередь для больных. В 2010-е годы в странах Евросоюза на него приходилось около 10% всех инфекций, который приобретаются в больнице. С P. aeruginosa связаны такие заболевания, как обструктивная болезнь легких, фиброзный цистит и, конечно, сепсис. Кроме того, синегнойная палочка часто приводит к инфекциям у онкологических больных и пациентов на искусственной вентиляции легких. Однако в последнее время P. aeruginosa пытаются использовать для лечения онкозаболеваний. Уже показано на мышах, что генетически модифицированная бактерия может приводить к регрессии опухоли.
Резистентность
Резистентность P. aeruginosa может обеспечиваться снижением проницаемости внешней мембраны, разрушениям антибиотика или его удалением из клетки. Такими способами бактерия может получить устойчивость к лактамам, хинолонам и аминогликозидам.
Отдельно стоит отметить низкую проницаемость ее внешней мембраны: она в 12–100 раз меньше, чем у кишечной палочки. Это достигается за счет отсутствия в клеточной стенке белков-поринов, через которые транспортируются антибиотики. У бактерии также могут преобладать поры в закрытой конформации, и это препятствует прохождению хинолонов или бета-лактамов.
Также справляться с антибиотиками помогают мутации и модификации белков. Например, отключение одной из систем репарации приводит к повышенному количеству мутаций, гиперэкспрессии бета-лактамаз и насосов, которые выкачивают антибиотики из клетки.
Особенность P. aeruginosa — образование биопленки, богатой внеклеточным матриксом. Биопленка затрудняет доступ антибиотика к клеткам, а сами клетки дифференцируются, чтобы эффективнее бороться против опасности.
Enterobacteriaceae (энтеробактерии)
История открытия
Это большое семейство бактерий было сформировано в 1936 году. К нему относятся кишечная палочка Escherichia coli и род Klebsiella. Многие члены семейства являются обычными обитателями кишечника, однако среди них есть и почвенные, водные и паразитические организмы. Эти бактерии — факультативные анаэробы.
Болезни
Кроме внутрибольничных инфекций, энтеробактерии могут стать причиной инфекций мочевыводящих путей, нижних дыхательных путей и заражений через раны. К представителям семейства также относится Salmonella, возбудитель сальмонеллеза. Она опасна в том числе выбросом токсинов, которые пагубно действуют на организм и могут привести к фатальным последствиям.
Резистентность
Благодаря специальным бета-лактамазам из группы ESBL (extended-spectrum beta-lactamase) энтеробактерии могут быть нечувствительны к более широкому спектру бета-лактамов, чем другие бактерии. Так, например, еще в 2000-е годы 20–30% инфекций в США были нечувствительны к третьему и четвертому поколению цефалоспоринов. Также энтеробактерии могут терять чувствительность к хинолонам из-за мутаций в гене-мишени.
Единственно эффективным способом уничтожения таких бактерий до недавнего времени были карбапенемы. Однако сейчас известны случаи устойчивости энтеробактерий к этим соединениям за счет приобретения карбапенемазы. Интересно, что эта резистентность специфична для таких регионов, как Китай, Саудовская Аравия, Индия, Греция и Колумбия.
Staphylococcus aureus
 Колонии Staphylococcus aureus. Credit: bacterianphotoes.com
Колонии Staphylococcus aureus. Credit: bacterianphotoes.com
История открытия
В 1880 году шотландский хирург Александр Огстон обнаружил эту бактерию в загноившейся ране. Через четыре года немецкий физиолог Фридрих Юлиус Розенбах смог изолировать золотистого стафилококка в отдельную культуру, обратив внимание на желтую окраску колонии. Цвет обусловлен обилием каротиноидов в мембране бактерии. Форма клетки коккоидная, а по способу дыхания золотистый стафилококк является грампозитивным факультативным анаэробом.
Болезни
В норме золотистый стафилококк можно найти в кишечнике, дыхательных путях и на коже. По статистике, он присутствует у 30% популяции. Считается, что S. aureus — патобионт, то есть симбионт, который при специфических условиях приводит к патологиям.
Наиболее часто пациенты страдают бактериемией, то есть инфекцией крови. По американским данным, в группе риска по этому заболеванию находятся престарелые люди из коренных народов и чернокожего населения США. Кроме того, бактерия может поражать легочные пути, суставы и кожу.
Резистентность
Особого внимания заслуживает золотистый стафилококк, резистентный к метициллину (MRSA). Изначально предполагалось, что метициллин станет заменой пенициллину, против которого бактерия уже выработала устойчивость. Однако уже в 1961 году, спустя год после начала использования препарата, в Великобритании был обнаружен устойчивый штамм. За последние 30 лет доля MRSA в нескольких странах значительно выросла. Например, в Финляндии частота инфекций MRSA поднялась с 5 до 25 человек на 100 000 населения. По данным ВОЗ, в некоторых странах около 80% золотистых стафилококков имеют резистентность к метициллину.
Считается, что резистентность появилась благодаря горизонтальному переносу генов. Так, золотистый стафилококк мог поглотить плазмиду с геном mecA, которая кодирует белок-мишень бета-лактамов с меньшей аффинностью к антибиотику.
Изначально штаммы MRSA встречались главным образом в больницах, но в последнее время стали появляться внебольничные варианты, распространяющиеся в популяции или через рогатый скот.
Для борьбы с MRSA предложили использовать пятое поколение цефалоспоринов и ванкомицин, однако в 2002 году стали появляться штаммы со сниженной чувствительностью и к ванкомицину. Для таких штаммов минимальная ингибирующая концентрация антибиотика в 2–8 раз больше обычной. Считается, что устойчивость обусловливается геном vanA. Его продукт помогает заменить мишень ванкомицина на ту, с которой антибиотик связаться не может.
Neisseria gonorrhoeae
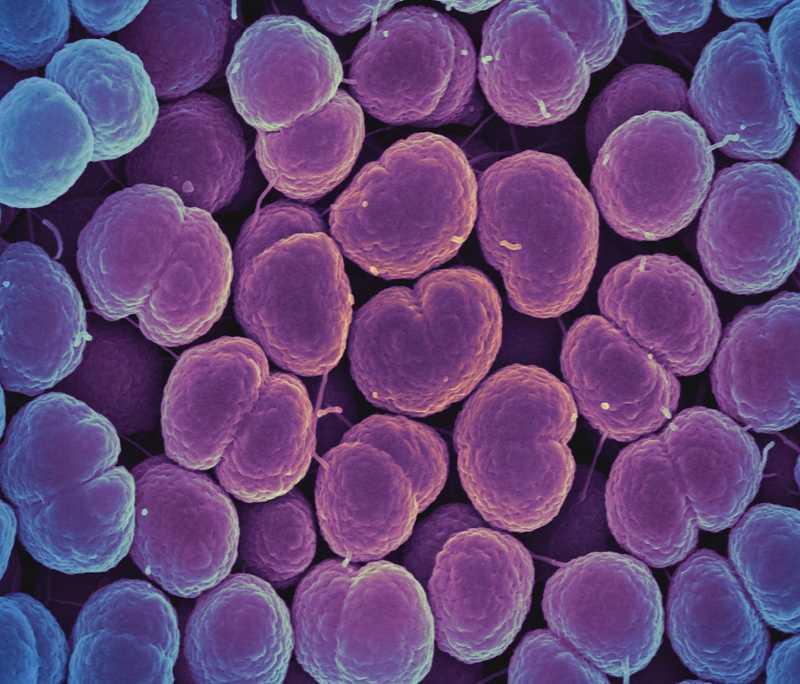 Neisseria gonorrhoeae. Credit: NIAID |
flickr.com
Neisseria gonorrhoeae. Credit: NIAID |
flickr.com
История открытия
Этот аэробный грамнегативный диплококк (то есть кокк, клетки которого образуют парные структуры, похожие на кофейное зерно) был открыт в 1879 году немецким врачом Альбертом Нейсером. В 1882 году ученые культивировали эту бактерию, а спустя год Макс Бокхарт доказал, что именно она вызывает гонорею.
Болезни
Гонорея известна людям с древних времен. Например, записи о похожей патологии можно найти в книгах древнего Китая XXVI века до нашей эры. Инфекция может поражать рот, гениталии и глаза. Обычно она передается половым путем, однако известны случаи заражения от матери к ребенку.
По статистике ВОЗ, в 2020 году появилось 82 миллиона новых случаев гонореи. Сейчас по количеству случаев в год это второе заболевание, передающееся половым путем (ЗППП), после хламидиоза. Однако возбудители хламидиоза, по оценке ВОЗ, не отличаются высокой частотой антибиотикорезистентности. Таким образом, гонорея — самое распространенное ЗППП с устойчивостью к антибиотикам.
В России на 2017 год было диагностировано 11 случаев гонореи на 100 тысяч населения. В 2021 году зафиксировано 6,7 случаев на 100 тысяч населения. Чаще этой болезнью заражаются мужчины.
Резистентность
Резистентную Neisseria gonorrhoeae обнаружили сравнительно недавно, в 2011 году в Японии. После этого резистентные штаммы находили в Великобритании, Франции и Австралии. Рост устойчивости положительно коррелирует с частотой использования антибиотиков. Например, в Нидерландах, где цефалоспорины назначают реже, чем в других странах, количество резистентных штаммов минимально.
Как бороться с антибиотикорезистентностью
Кроме поиска новых антибиотиков и новых мишеней, можно выделить еще несколько интересных направлений. Перспективным считается уничтожение механизмов устойчивости. К примеру, некоторые группы ищут селективные ингибиторы для насосов, которые выкачивают антибиотики из клетки. Другие исследователи пытаются инактивировать бета-лактамазы. Также развивается идея о лекарствах, которые будут разрушать биопленки и мешать взаимодействию между бактериями.
Еще одно очень интересное направление — снижение вирулентности бактерий: ученые пытаются разработать вещество, которое не убивает бактерию, а блокирует вирулентные факторы, присутствующие только на стадии инфекции. Например, два года назад ученые предложили таким способом бороться с резистентной синегнойной палочкой (подробнее на PCR.NEWS).
Кроме научных инновационных подходов, существуют простые рекомендации ВОЗ для обычных граждан:
-
Использовать антибиотики только по предписанию врача.
-
Всегда следовать советом врача при лечении антибиотиками.
-
Не продавать или отдавать самостоятельно антибиотики другим людям. Сейчас в России стали появляться специальные пункты для приема просроченных или ненужных лекарств.
-
Мыть руки, пить чистую воду, не забывать о тепловой обработке продуктов и соблюдать другие профилактические нормы.


 Меню
Меню





 Все темы
Все темы




 0
0








