γ-Линоленовая кислота в материнском молоке отвечает за метаболическое созревание сердца
Ученые из Испании выяснили, что метаболическое репрограммирование кардиомиоцитов после рождения происходит за счет γ-линоленовой кислоты, поступающей в организм ребенка с молоком матери. Активируя RXR рецепторы, она переключает метаболизм клеток с использования глюкозы на утилизацию жирных кислот. Таким способом осуществляется материнский контроль над перинатальным сердечным метаболизмом.
Credit:
CNIC
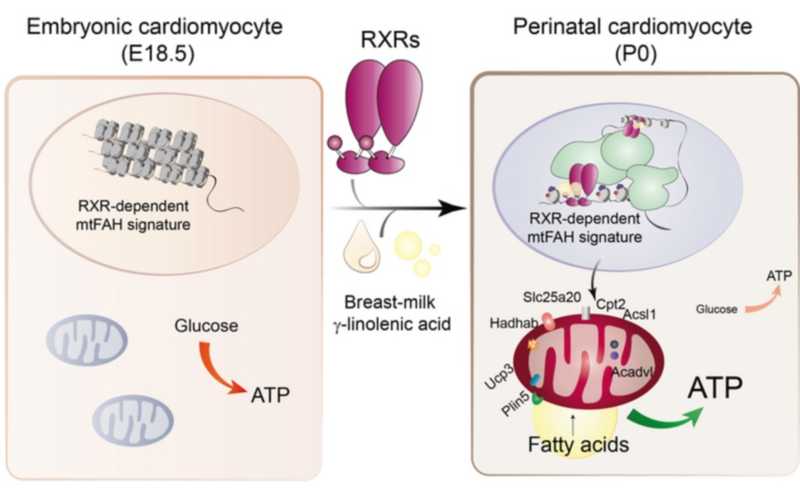
Сердце млекопитающих имеет достаточно гибкий метаболизм и может получать энергию из множества соединений: глюкозы, жирных кислот и др. Кардиомиоциты плода в большей степени утилизируют глюкозу и лактат, тогда как после рождения главным источником АТФ становится митохондриальное окисление липидов. Переключение метаболизма сердца происходит в первые две недели жизни, в результате митохондрии начинают эффективно осуществлять β-окисление жиров. Этот адаптивный процесс очень важен в формировании сердца, однако его молекулярные механизмы не до конца изучены.
Предполагается, что в формировании сердца новорожденных играют роль ретиноидные X-рецепторы (RXR). Это лиганд-регулируемые транскрипционные факторы, которые могут активироваться под действием 9-цис-ретиноевой кислоты и других эндогенных жирных кислот. На мышах было показано, что полное отключение генов, кодирующих RXR, приводит к неправильному росту миокарда и смерти, однако физиологическая роль этих рецепторов в гомеостазе кардиомиоцитов остается неизвестной. Исследователи из Национального центра сердечно-сосудистых исследований подробнее изучили связь RXR с метаболическим репрограммированием сердца.
Было показано, что полный нокаут RXR (embryonic double knockout, EDKO) приводил к смерти у 80 % мышей в течение первых 24 часов, оставшиеся не проживали дольше 7 дней. ЭХО-КГ выявляла значительное снижение фракции выброса, что свидетельствует о серьезной сократительной дисфункции сердца. Кроме того, у таких мышей снижались ударный объем, сердечный выброс и конечное систолическое давление в левом желудочке. Изменений в других органах найдено не было, гистологическая картина сердца не выявила морфологических нарушений. Все это указывало на связь экспрессии RXR с поддержанием функционирования сердца и неонатальной выживаемостью.
Анализ уровня экспрессии генов в сердце EDKO-мышей и последующий анализ генной онтологии показали снижение активности окисления жирных кислот. Также авторы с помощью qPCR выявили снижение экспрессии митохондриальных генов, отвечающих за гомеостаз жирных кислот (mtFAH гены). Протеомный анализ мышиных сердец подтвердил, что при снижении экспрессии RXR уменьшается количество белков, участвующих в метаболизме липидов. При этом не было обнаружено никаких нарушений в морфологии или числе митохондрий. Это указывало на то, что в отсутствие RXR метаболизм кардиомиоцитов не мог перестроиться и был направлен на анаэробное использование глюкозы. Измерение активности окисления глюкозы и продукции лактата подтвердило такое предположение.
С помощью полногеномного анализа, основанного на комбинации ATAC-seq и ChIP-seq, ученые обнаружили, что отсутствие RXR в эмбриональных кардиомиоцитах приводило к эпигенетическим изменениям. При выявленных нарушениях организации хроматина была невозможна RXR-зависимая экспрессия mtFAH генов.
Так как материнское молоко является источником многих сигнальных молекул, влияющих на метаболизм, ученые решили проверить связь грудного вскармливания с RXR-зависимой экспрессией mtFAH генов. Для этого они проанализировали экспрессию мРНК у контроля и двух групп мышей EDKO на разных диетах. Результаты показали, что экспрессия mtFAH генов снижалась у тех мышей, которых не кормили материнским молоком. Дальнейшее исследование мышей на безжировой диете и на диете без витамина А продемонстрировали, что экспрессия mtFAH генов снижалась только при дефиците жирных кислот, в большей степени омега-6 жирных кислот.
Затем исследователи провели липидомный анализ материнского молока, чтобы выяснить, какие именно лиганды RXR могут в нем содержаться. Оказалось, что таким соединением является γ-линоленовая кислота (GLA) — представитель омега-6 жирных кислот, способный стабилизировать RXR. Анализ экспрессии генов показал, что под воздействием γ-линоленовой кислоты RXR-зависимо возрастает экспрессия mtFAH генов. Вскармливание мышей обезжиренным молоком, искусственно обогащенным GLA, способствовало их нормальному развитию и повышало экспрессию mtFAH генов в их кардиомиоцитах. Дополнительные опыты с использованием поверхностного плазмонного резонанса, а также in silico моделирование подтвердили, что GLA является лигандом RXR.
Таким образом, исследователи обнаружили, что ось GLA-RXR является ключевым регуляторным механизмом, лежащим в основе материнского контроля перинатального метаболизма сердца. Этот результат может послужить основой для разработки терапий неонатальных сердечных заболеваний и системных заболеваний, вызванных нарушениями в метаболизме. Авторы также отмечают, что этот механизм указывает на важность полноценной диеты для кормящих женщин: в пище должно быть достаточно GLA или её метаболических предшественников, чтобы обеспечить необходимый уровень GLA в грудном молоке.
Клеточный состав грудного молока меняется в течение лактационного периода


 Меню
Меню





 Все темы
Все темы




 0
0