Антитело для терапии нейромиелита зрительного нерва влияет на фенотип B-клеток
Нейромиелит зрительного нерва со спектральным расстройством — аутоиммунное заболевание, поражающее центральную нервную систему. Исследователи из Японии обнаружили, что препарат для терапии этого заболевания — сатрализумаб — не влияет на число B-клеток, но изменяет их фенотип. Он повышает уровень экспрессии противовоспалительного IL-10 плазмобластами — зрелыми B-клетками — и придает им регуляторный фенотип. Определить такие B-клетки можно по поверхностному белку CD200.
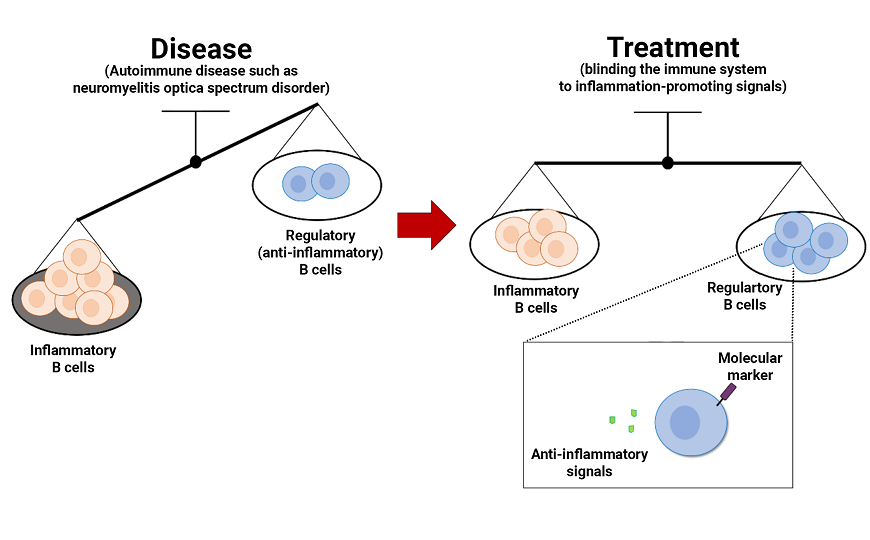
Нейромиелит зрительного нерва со спектральным расстройством (neuromyelitis optica spectrum disorder, NMOSD) — это редкое аутоиммунное заболевание, для которого характерно воспаление, в основном поражающее зрительный нерв, спинной мозг и ствол мозга. Аутоантитела, направленные против AQP4, играют ключевую роль в патогенезе NMOSD. Это состояние, которое иногда проявляется периодическими обострениями, можно облегчить за счет блокировки воспалительных сигналов. Ранние исследования показали, что соотношения различных типов В-клеток различаются у больных с NMOSD и у здоровых людей. Например, у пациентов с NMOSD было обнаружено большое число плазмобластов (PB) — зрелых и дифференцированных B-клеток — в составе мононуклеарных клеток периферической крови (PBMC), что может быть связано с заболеванием. Кроме того, в сыворотке и спинномозговой жидкости пациентов с NMOSD были обнаружены повышенные уровни интерлейкина 6 (IL-6), фактора выживания PB, производящих антитела против AQP4. Были проведены успешные клинические испытания моноклонального антитела, блокирующего рецептор IL-6 (IL-6R) — сатрализумаба. Однако не до конца понятно, как препарат влияет на фенотип лимфоцитов у пациентов с NMOSD.
Ученые из Токийского университета (Япония) предположили, что патогенезу NMOSD способствует нарушение работы регуляторных B-клеток (Breg), но их функцию можно восстановить, заблокировав IL-6R. Breg секретируют противовоспалительный цитокин IL-10, но их роль в развитии NMOSD не до конца понятна.
Чтобы проверить свою гипотезу, авторы проанализировали фенотип B-клеток у пациентов с NMOSD. Доля двойных отрицательных B-клеток (DN; CD3−, CD19+, IgD−, CD27−) и PB (CD3−, CD19+, CD27hi, CD38hi) среди B-клеток у пациентов с NMOSD во время обострений увеличивалась по сравнению со здоровыми контролями. Кроме того, доля B-клеток памяти (SWM; CD3−, CD19+, IgD−, CD27+) была выше, а доля наивных B-клеток (NAV; CD3−, CD19+, IgD+, CD27−) — ниже у пациентов с NMOSD по сравнению со здоровыми контролями. Стоит отметить, что с достижением ремиссии количество DN и PB уменьшилось. В то же время лечение сатрализумабом не повлияло на количество DN или PB. Вероятно, терапия влияла на фенотип B-клеток, а не на их количество или соотношение различных типов.
Затем исследователи определили, влияют ли антитела к IL-6R на регуляторные функции B-клеток. Изначально уровень экспрессии IL-10 B-клетками был ниже у пациентов с NMOSD, чем у контролей. Антитела повышали экспрессию IL-10 в PB, но не в DN B-клетках. Уровень экспрессии IL-10 в PB приближался к уровню, характерному для здоровых контролей.
Дальнейший анализ экспрессии генов в PB выявил потенциальные маркеры регуляторных PB на поверхности В-клеток — CD200, TXK, SLC9A3 и TMEM11. Ученые проанализировали секрецию цитокинов и обнаружили, что CD200+ PB производят больше IL-10, чем CD200- PB. Также было показано, что как CD200+ наивные B-клетки, так и CD200+ B-клетки памяти дифференцировались в PB в ответ на стимуляцию.
Анализ PBMC пациентов с NMOSD подтвердил способность CD200+ PB вырабатывать IL-10. В PBMC пациентов с NMOSD доля CD200+ PB была значительно выше в фазе ремиссии при лечении сатрализумабом, чем во время обострений. Более того, после введения сатрализумаба у пациентов не было зарегистрировано рецидивов. Интересно, что у пациентов, получающих сатрализумаб, доля CD200+ PB отрицательно коррелировала с возрастом.
Таким образом, ученые показали, что блокировка сигнального пути IL-6 индуцировала регуляторный фенотип у PB, а CD200+ PB могут быть маркером чувствительности к лечению NMOSD. В перспективе полученные результаты могут помочь развитию персонализированной медицины для аутоиммунных заболеваний.
Обнаружен новый маркер для диагностики заболеваний, связанных с демиелинизацией ЦНС
Источник:
Ritsu Akatani, et al., Interleukin-6 Signaling Blockade Induces Regulatory Plasmablasts in Neuromyelitis Optica Spectrum Disorder. // Neurol Neuroimmunol Neuroinflamm, June 18, 2024; 11:e200266. DOI: 10.1212/NXI.0000000000200266


 Меню
Меню





 Все темы
Все темы




 0
0







