CAR-T терапия рецидивирующей глиомы прошла фазу 1 клинических исследований
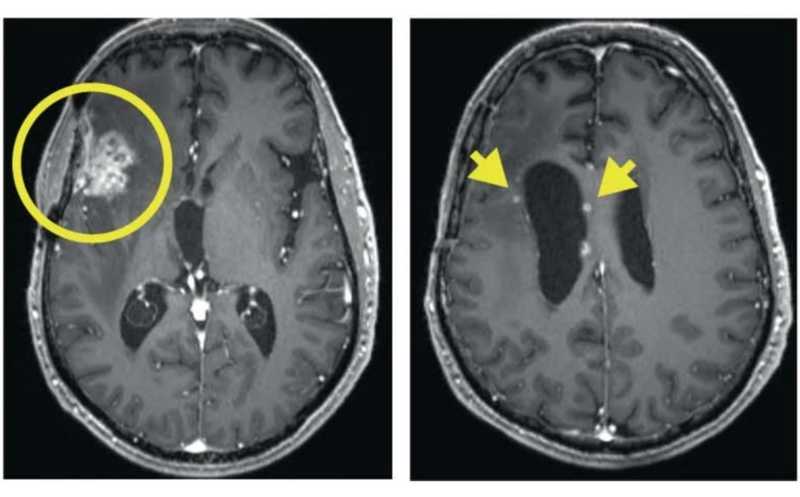
Диффузная глиома высокой степени злокачественности, к которой также относится глиобластома, трудно поддается лечению. Американские ученые опубликовали результаты фазы 1 клинических испытаний CAR-T терапии рецидивирующей глиомы, где CAR-T-клетки вводили в спинномозговую жидкость или в опухоль, а мишенью был выбран рецептор IL-13Rα2. Более чем в 50% случаев исследователям удалось стабилизировать течение болезни или улучшить состояние пациентов, а медианная выживаемость составила 8 месяцев.
Credit:
Nature Medicine (2024). DOI: 10.1038/s41591-024-02875-1 | CC BY
Диффузная глиома высокой степени злокачественности (high grade glioma) трудно поддается лечению стандартными методами, в числе которых хирургическое удаление опухоли, радио- и химиотерапия. Подтипом глиомы является глиобластома (астроцитома 4 степени с IDH дикого типа по классификации ВОЗ) — очень агрессивный вид рака с худшим прогнозом среди всех глиом.
Ученые американского центра City of Hope представили результаты фазы 1 клинических испытаний CAR-T терапии для лечения рецидивирующей глиомы высокой степени злокачественности, в том числе глиобластомы. Мишенью CAR-T-клеток выбрали рецептор IL-13Rα2, который экспрессируется большинством глиом высокой степени злокачественности. При этом IL-13Rα2 не представлен в нормальной нервной ткани, хотя и экспрессируется также в тестикулах. В работе ученые использовали CAR, содержащий IL-13 с мутацией E12Y и костимулирующий домен 4-1BB. Такая конструкция повысила селективность CAR-T-клеток, которые стали предпочтительнее распознавать именно IL-13Rα2, а не IL-13Rα1, который обладает меньшей аффинностью к своему лиганду, но обладает более широким профилем экспрессии.
В клинических испытаниях принимали участие пациенты, которые до этого проходили другие варианты терапии глиомы. Всего в исследование было включено 92 пациента в период с 2015 по 2020 год, однако в итоге оценить влияние терапии удалось всего на 58 пациентах. Остальные были исключены из испытаний по разным причинам, из-за которых они не смогли пройти терапию полностью или частично. 75% из участников получали CAR-T терапию после как минимум второго рецидива, и у 70% из них была рецидивирующая глиобластома с IDH дикого типа.
Всего в испытании было пять групп: в трех из них проверялся способ введения терапии, в двух — платформы для производства CAR-T-клеток. В группе 1 клетки вводили в опухоль после биопсии, в группе 2 — в опухоль после ее хирургической резекции, в группе 3 — в спинномозговую жидкость (СМЖ), в группах 4 и 5 совмещали введение в опухоль и в СМЖ. В группах 1-4 использовали CD62L+, CD45RA- центральные Т-клетки памяти (Tcm), а в группе 5 — CD62L+ обогащенные наивные Т-клетки, стволовые и центральные Т-клетки памяти (Tn/mem). Пациентам вводили CAR-T клетки еженедельно на протяжении трех недель в одном из режимов дозировки (2–200 × 106 клеток), после чего вели наблюдение в течении недели, чтобы обнаружить дозолимитирующие токсические эффекты. После этого пациентам могли дополнительно вводить CAR-T-клетки с повышением дозировки.
По итогам фазы 1 клинических испытаний ученые не выявили никаких дозолимитирующих токсических эффектов, поэтому не смогли определить максимально переносимую дозу терапии. Наиболее частыми побочными эффектами стали усталость, головная боль и повышение давления. Токсические эффекты третьей степени и выше встречались у 35% пациентов, в том числе был один случай энцефалопатии и один случай атаксии.
После терапии у 50% пациентов течение болезни стабилизировалось либо улучшилось, у 22% улучшение длилось дольше 90 дней, причем у большинства из них была глиома 4 степени. У двух пациентов ответ стал частичным, а у одного — полным, при этом у всех троих были глиомы 3 степени с мутированным IDH.
Медианная выживаемость пациентов составила 8 месяцев для всех пациентов и 7,7 месяцев для пациентов с глиобластомой. Наилучшая выживаемость была в группе 5 — 10,2 месяцев, тогда как в группах 1–4 средняя выживаемость составила 6,1 месяцев. Качество жизни пациентов также значительно повысилось в группе 5 по сравнению с группами 1-4. Post hoc анализ показал, что иммунотерапия глиобластомы оказалась весьма эффективной. Так, согласно литературным данным, выживаемость пациентов с глиобластомой после первого рецидива находится в диапазоне от 5,5 до 12,6 месяцев, а после лечения бевацизумабом составляет 3,3–3,4 месяца. В фазе 3 клинических испытаний терапии электрическими полями (TTFields), где у большинства пациентов было как минимум два рецидива, медианная выживаемость составила 6,6 месяцев при использовании TTFields и 6 месяцев при использовании химиотерапии.
Более хорошие результаты в группе 5 по сравнению с группами 1–4 указали на то, что для производства CAR-T-клеток Tn/mem-клетки подходят лучше, чем Tcm. Именно в группе 5 ученым удалось добиться максимально возможной дозы для производства — 200 × 106 клеток. При использовании Tn/mem-клеток продукт получался более однородным, и такие CAR-T-клетки дольше персистировали в периферической крови. Такое превосходство Tn/mem-клеток над Tcm согласуется с другими исследованиями CAR-T терапии для лечения раков крови.
Исследователи отметили, что после каждого введения CAR-T-клеток в СМЖ и в жидкости вместе опухоли повышался уровень провоспалительных и стимуляторных цитокинов. В особенности активизировался путь IFNγ (повышалась выработка IFNγ, хемокинов CXCL9, CXCL10), что может быть биомаркером активности CAR-T-клеток. Наибольшая активность пути IFNγ достигалась в группе 5, где применялись Tn/mem-клетки.
Ученые также попытались выявить биомаркеры в микроокружении опухоли, которые могут быть ассоциированы с ответом на CAR-T терапию. Они оценили инфильтрацию Т-клеток в опухоль до применения CAR-T-клеток. В большинстве опухолей присутствовало мало CD3+ клеток, что характерно для «холодного» микроокружения глиобластомы. Однако в 25% случаев инфильтрация CD3+ клеток была средней или высокой, причем уровни CD3+ клеток коррелировали с инфильтрацией CD8+ Т-клеток, которых было больше, чем Т-регуляторных клеток. По итогам испытаний ученые сделали вывод о том, что средняя и высокая инфильтрация CD3+ клеток в опухоль до лечения была ассоциирована с улучшенной выживаемостью у всех пациентов и у пациентов с глиобластомой. У таких пациентов выживаемость была в два раза выше, чем у пациентов с «холодным» микроокружением опухоли. Исследователи также отметили, что в некоторых случаях ответ на CAR-T терапию у пациентов со средней и высокой инфильтрацией Т-клеток в опухоль был значительно лучше, чем на другие виды терапии до рецидивов.
В будущем ученые планируют провести рандомизированные испытания с более крупными когортами пациентов, продолжая использовать схему лечения группы 5 — введение CAR-T-клеток на основе Tn/mem-клеток одновременно в СМЖ и в опухоль. Исследователи намерены продолжить работу, включив в испытания дизайны CAR следующего поколения (в том числе биспецифические CAR) и комбинированную терапию.
Источник
Brown, C. E. et al. Locoregional delivery of IL-13Rα2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. // Nature Medicine (2024). DOI: 10.1038/s41591-024-02875-1


 Меню
Меню





 Все темы
Все темы




 0
0







