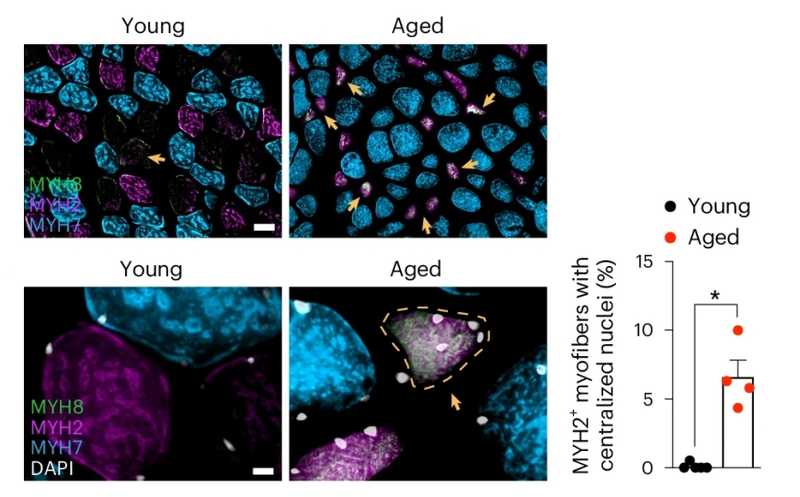
Дефицит регуляторных Т-клеток провоцирует тревогу и депрессию
Уже существуют данные о связи регуляции иммунитета с расстройствами настроения. Недавнее исследование на мышиной модели демонстрирует роль регуляторных Т-клеток в этом процессе — при их недостатке в периферической крови животные начинали проявлять признаки тревожности и депрессии, а восстановление нормального иммунного профиля способствовало снижению этих симптомов.

Регуляторные Т-клетки (Treg) — ключевые регуляторы адаптивного иммунитета, однако предыдущие работы также свидетельствуют о том, что они могут влиять на настроение. Снижение экспрессии Foxp3 — транскрипционного фактора, контролирующего продукцию регуляторных Т-клеток, — ассоциировано с развитием депрессивных расстройств. Недавняя работа в PNAS демонстрирует эту связь на мышиной модели: животные с дефицитом регуляторных Т-клеток проявляли признаки тревожного и депрессивного поведения.
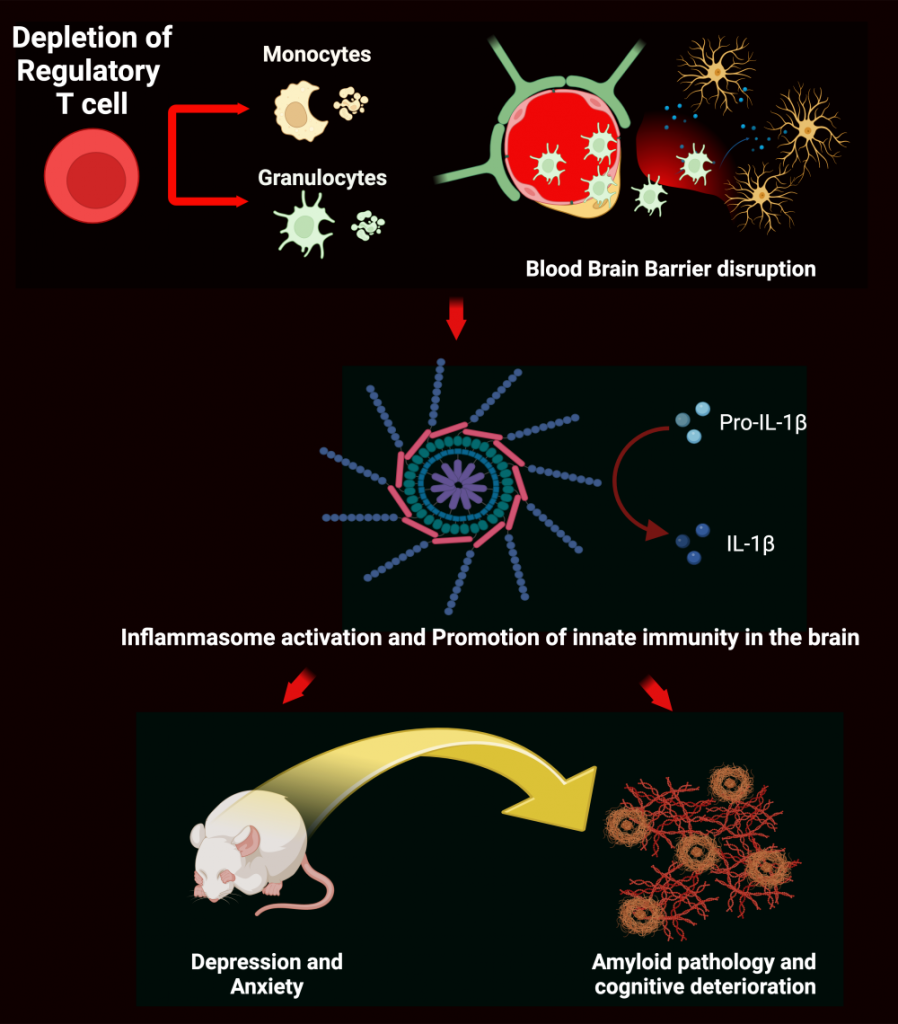 Дефицит периферических Foxp3+-клеток привел к повышению уровня моноцитов и гранулоцитов, повреждению гематоэнцефалического барьера и активации инфламмасомы в головном мозге. Это вызвало у модельных животных симптомы тревоги и депрессии, а также усилило биохимические признаки болезни Альцгеймера у 5xFAD мышей.
Дефицит периферических Foxp3+-клеток привел к повышению уровня моноцитов и гранулоцитов, повреждению гематоэнцефалического барьера и активации инфламмасомы в головном мозге. Это вызвало у модельных животных симптомы тревоги и депрессии, а также усилило биохимические признаки болезни Альцгеймера у 5xFAD мышей.Credit:
Pasinetti et al. | пресс-релиз
Чтобы временно снизить уровень регуляторных Т-клеток у мышей, авторы получили модельных животных, экспрессирующих рецептор дифтерийного токсина под контролем промотора Foxp3. После введения дифтерийного токсина таким животным в их периферической крови уменьшалось количество клеток, экспрессирующих Foxp3, примерно на 60%, и этот эффект был обратимым.
Исследователи изучили поведение таких мышей: они оценивали проявления тревожности и депрессивного поведения, а также проверяли общий уровень двигательной активности. Мыши, лишенные регуляторных Т-клеток, проводили в темноте существенно больше времени, чем животные из контрольной группы, что указывает на более высокий уровень тревожности.
Признаки депрессии у мышей ученые оценивали при помощи теста «вынужденного плавания». Для этого животных помещали в прозрачный пластиковый цилиндр, частично заполненный водой, и определяли, насколько активно животное старается удержаться на плаву. Мыши со сниженным уровнем регуляторных Т-клеток больше времени проводили в воде неподвижно — принято считать, что такое поведение служит показателем депрессивного состояния.
При этом описанные поведенческие эффекты, как и искусственно созданный дефицит регуляторных Т-клеток, были временными. После того, как авторы работы прекращали вводить мышам дифтерийный токсин, поведение животных нормализовалось — уровень тревоги и депрессивных проявлений возвращался к контрольным показателям.
Чтобы установить молекулярный механизм, лежащий в основе связи Foxp3 с изменениями в поведении, ученые провели секвенирование РНК мышиного гиппокампа. Эта структура мозга — одна из ключевых областей, вовлеченных в тревожное и депрессивное поведение у грызунов. Анализ дифференциальной экспрессии выявил изменения нескольких сигнальных путей. В их числе интерфероновый сигналинг, рецепторное распознавание бактериальных и вирусных паттернов, гиперцитокинемия/гиперхемокинемия в патогенезе гриппа. Кроме того, изменениями оказались затронуты гены клеточного иммунного ответа и миграции иммунных клеток.
Авторы также оценили экспрессию четырех генов, ассоциированных с воспалительными процессами: Cxcl10, Nlrp3, IL-1β и каспазы 1. Количественная ПЦР выявила повышенные уровни мРНК всех четырех генов в гиппокампе мышей с дефицитом регуляторных Т-клеток. Это говорит об индукции провоспалительного ответа и активации инфламмасом.
Чтобы подробнее описать иммунный профиль животных, исследователи изучили состав их периферической крови. Они установили, что дефицит Foxp3+-клеток изменил соотношение клеточных субпопуляций : при снижении количества регуляторных Т-клеток доля гранулоцитов и макрофагов у мышей возросла. Также в их крови изменился уровень шести цитокинов: интерферона гамма (IFN-γ), колониестимулирующего фактора макрофагов (M-CSF), интерлейкина-13 и TREM-1 у них было больше, а тканевого ингибитора металлопептидазы 1 (TIMP-1) меньше, чем у животных из контрольной группы.
При дефиците регуляторных Т-клеток также возрастал уровень матриксной металлопротеиназы MMP-9 в гиппокампе. Этот белок продуцируется гранулоцитами, и существуют данные, что он способен повреждать гематоэнцефалический барьер (ГЭБ). На фоне провоспалительного профиля периферической крови такие повреждения могут инициировать нейровоспаление, которое ученые связывают с развитием тревожности и признаков депрессии.
Авторы отмечают, что в крови пациентов с большим депрессивным расстройством часто наблюдается повышенный уровень провоспалительных реакций — это подчеркивает связь между воспалением и повышенным риском развития аффективных расстройств, включая депрессию и тревогу.
Кроме того, ученые обнаружили, что снижение числа регуляторных Т-клеток затрагивало предшественник β-амилоида — на это указал анализ молекулярных путей (ingenuity pathway analysis). Это подтолкнуло их изучить роль явления еще и в болезни Альцгеймера (БА). Исследователи создали дефицит регуляторных Т-клеток у 5xFAD мышей — распространенной модели БА. Оказалось, что в мозге таких мышей менялось соотношение изоформ β-амилоида (Aβ). У них сильнее, чем у контрольных животных, снижался уровень изоформы Aβ1–40 и возрастала доля Aβ1–42. Именно второй вариант участвует в патогенезе болезни Альцгеймера. Когнитивные функции, которые авторы оценивали по способности мышей отличать новые объекты от знакомых, при недостатке регуляторных Т-клеток у 5xFAD мышей снижались быстрее, чем в обычной модели болезни Альцгеймера.
Исследование подтверждает, что периферические иммунные реакции, вызванные нарушением экспрессии Foxp3, могут индуцировать провоспалительный каскад в мозге и тем самым приводить к тревожно-депрессивному поведению или снижению когнитивных функций, в частности, ускоряя патогенез болезни Альцгеймера.
Психические расстройства связаны с риском развития иммунных заболеваний
Источник
Eun-Jeong Yang et al. Transient anxiety-and depression-like behaviors are linked to the depletion of Foxp3-expressing cells via inflammasome in the brain // PNAS Nexus, Volume 2, Issue 8, August 2023, pgad251. DOI: 10.1093/pnasnexus/pgad251








 Меню
Меню





 Все темы
Все темы






 0
0