Дифференцировку прогениторных клеток желудка регулирует сигнальный путь EGFR
Нарушения процессов дифференцировки лежат в основе многих заболеваний желудка, начиная от поверхностного гастрита и заканчивая раком. Ученые из Японии охарактеризовали процессы созревания прогениторных клеток в различные типы зрелых клеток желудочного эпителия. Они описали сигнальные пути, регулирующие такую дифференцировку — оказалось, что ее ключевым регулятором выступает EGFR.
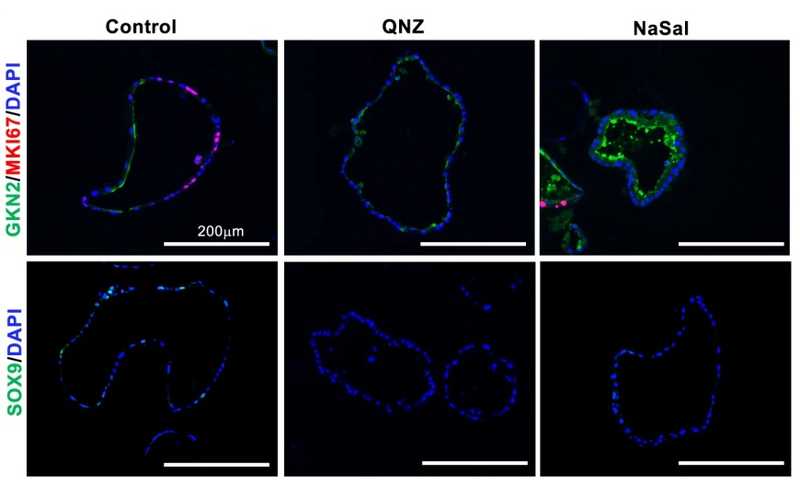
Органоиды желудка мышей, культивированные в присутствии ингибиторов NF-κB сигналинга (QNZ и NaSal). Иммунохимически окрашены маркеры прогениторных (MKI67, красный), фовеолярных и шеечных клеток (GKN2 и SOX9, соответственно; зеленый цвет), а также ядра (DAPI, синий).
Credit:
Nature Communications (2023). DOI:
10.1038/s41467-023-39113-0 |
CC BY
Эпителий тела желудка, в большей степени выполняющий секретирующую функцию, постоянно обновляется. За это отвечают популяции прогениторных клеток, расположенные в перешейках желез желудка. В ходе дифференцировки из них образуются париетальные клетки, секретирующие соляную кислоту, главные клетки, выделяющие протеазы, и мукоциты, производящие слизь (фовеолярные и шеечные клетки), а также эндокринные клетки. Нарушения созревания этих клеток приводят к различным патологиям: псевдопилорическая метаплазия, болезнь Менетрие, синдром Золлингера-Эллисона. На сегодняшний день механизмы нарушения дифференцировки и связанные с ними сигнальные пути изучены слабо.
Чтобы проанализировать динамику экспрессии генов в процессе дифференцировки прогениторных клеток в теле желудка мышей, группа под руководством ученых из института науки и технологий Нара использовала Quartz-Seq2 — методику секвенирования РНК единичных клеток (scRNA-seq), которую принято считать наиболее точной из ныне доступных. Этот подход к высокопроизводительному scRNA-seq отличается высокой чувствительностью и надежностью идентификации генов даже при ограниченной глубине прочтений.
Авторы работы проанализировали экспрессию генов в зависимости от псевдовремени, которое характеризовало стадии дифференцировки клеток. Результаты такого профилирования совместно с анализом обогащения выявили основные пути, активирующиеся при переходе от перешеечной (прогениторной) клетки к различным зрелым потомкам. В дифференцировку были в первую очередь вовлечены сигнальные пути интегрина, EGFR (рецептор эпидермального фактора роста) и MAPK.
Более подробный анализ показал, что EGFR сигналинг направлял клетки по пути дифференцировки фовеолярных, но не шеечных мукоцитов. Кроме того, созреванию в этом направлении способствовал сигнальный путь TGFα. Сигналинг NF-κB, напротив, тормозил дифференцировку. Так, кластеры генов, экспрессирующихся преимущественно в прогениторных клетках, были ассоциированы с сигнальными путями TNF-α (фактор некроза опухолей)/NF-kB и протеасомной деградацией.
Детали межклеточных взаимодействий ученые охарактеризовали с помощью CellChat. Этот анализ выявил активацию сигнальных путей EGF преимущественно в фовеолярных клетках, TNF путей в перешеечных клетках, а также низкий уровень активации пути NOTCH в париетальных клетках. Это согласуется с полученными данными о функциональном обогащении псевдозависимых от времени генов. Анализ экспрессии лигандов и рецепторов с помощью иммунофлюоресцентного окрашивания подтвердил, что TGFα-EGFR сигнальные пути участвуют в дифференцировке фовеолярных клеток.
Дальнейшее изучение созревания фовеолярных клеток авторы проводили на органоидах желудка, которые состояли преимущественно из прогениторных и слабодифференцированных клеток. При культивировании этих органоидов с TGFα в их клетках увеличивалась экспрессия маркеров зрелых фовеолярных клеток, а маркеры прогениторных клеток экспрессировались слабее. Напротив, при добавлении к культуре ингибитора EGFR экспрессия маркеров фовеолярных клеток значимо снижалась. Все это подтверждает ведущую роль сигнального пути EGFR в дифференцировке фовеолярных клеток желудка.
Как ранее показал анализ обогащения, дифференцировка клеток сопровождалась подавлением сигналинга TNF-NFκB. Для уточнения его роли в созревании клеток исследователи также использовали систему органоида желудка, к которой добавляли один из главных активаторов этого сигнального пути — лиганд Tnfsf12-Tnfrsf12a. Это значительно снижало экспрессию маркеров фовеолярных клеток, что говорит о ингибирующем влиянии сигнального пути TNF-NFκB на дифференцировку клеток. Ученые подтвердили этот вывод иммунофлуоресцентным окрашиванием соответствующих маркеров, а также опытами с ингибированием NF-κB.
Также исследователи провели опыты на мышах с применением ингибитора EGFR и последующим иммуногистохимическим анализом. Их результаты подтвердили, что сигнальный путь EGFR запускает дифференцировку фовеолярных клеток.
Таким образом, исследователи определили молекулярные механизмы, отвечающие за созревание клеток желудка в условиях нормального гомеостаза. Акира Курисаки, один из ведущих авторов, отмечает: «Мы знали, что сигнальный путь EGFR неразрывно связан с раком желудка, а некоторые рецепторы EGF оверэкспрессируются при различных видах рака. Тем не менее, было приятным сюрпризом обнаружить в нашем анализе единичных клеток, что сигнальный путь EGFR способствует дифференцировке, но не играет митогенную роль в здоровом желудочном гомеостазе».
Цитата по пресс-релизу
Белок GREM1 регулирует дифференцировку клеток опухоли поджелудочной железы


 Меню
Меню





 Все темы
Все темы




 0
0








