Фиброзная ткань защищает оставшиеся после удаления опухоли клетки глиобластомы
Выживаемость людей с глиобластомой все еще низкая из-за частых рецидивов. Исследователи из Швейцарии показали, что после удаления глиобластомы в тканях мозга образуется область фиброза. Она защищает оставшиеся опухолевые клетки от иммунного ответа и тем самым способствует рецидиву. Если ввести одновременно с противоопухолевым препаратом вещества, препятствующие образованию фиброзной ткани, частота рецидивов у мышей падает, а выживаемость увеличивается.
Среди опухолей мозга взрослых людей наиболее распространена глиобластома. При лечении глиобластомы используют хирургическое удаление опухоли, химиотерапию на основе темозоломида и радиотерапию. Однако медиана выживаемости пациентов едва превышает 14 месяцев, а пятилетняя выживаемость составляет менее 5%, так как практически во всех случаях происходит рецидив глиобластомы. Исследователи из Швейцарии выяснили, почему происходит рецидив и какие шаги можно предпринять, чтобы его предотвратить.
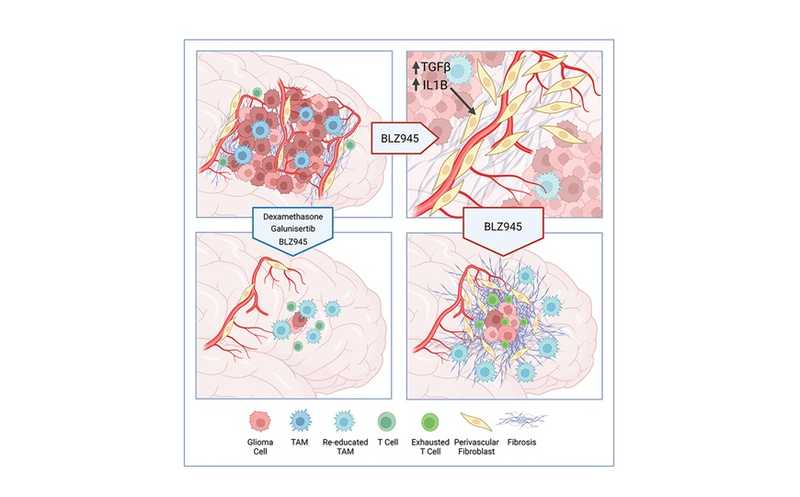
Большое число ассоциированных с опухолью макрофагов и микроглии (TAM) связано с поздней стадией и плохим прогнозом. В ранних работах авторы предлагали таргетировать TAM, блокируя CSF-1R сигналинг. В доклинике такая стратегия значительно повысила выживаемость, однако у 50% мышей происходил рецидив. Интересно, что всегда новые опухоли вырастали рядом со шрамом, оставшимся после удаления старой.
Известно, что фиброз может как останавливать развитие опухолей вне мозга, так и способствовать в зависимости от контекста. Так, на ранних стадиях фиброз замедляет рост и мешает локальной инвазии, на поздних же стадиях повышение жесткости ткани и реорганизация внеклеточного матрикса активируют подвижность опухоли, помогают избегать активности иммунитета и стимулируют пролиферацию опухолевых клеток.
Авторы использовали мышиную модель, у которой опухоли образуются через 4–5 недель после специального воздействия. Под действием ингибитора CSF-1R (BLZ945) опухоль уменьшается (0–14 день), некоторое время находится в состоянии покоя (28 день), а потом или рецидивирует, или не проявляет себя до конца эксперимента. Анализ остатков опухоли на 28 день выявил коллаген I типа, а также CD13, коллаген IV и фибронектин. Ядро шрама было окружено GFAP+ астроцитами. Такое строение шрама встречается и при травмах головы и инсульте. Рецидивирующие опухоли всегда находятся рядом со шрамом. То же было показано на уничтоженных радиотерапией опухолях мышей.
Анализ первичных и рецидивирующих опухолей пациентов показал, что в последних было больше коллагена (признака фиброза). Также была отмечена характерная пространственная архитектура белков внеклеточного матрикса. Протеомный анализ опухолей мышей продемонстрировал, что состав рецидивирующих опухолей значительно меняется.
После снижения размера опухоли повышалась область фиброза. И эта область служила защитной нишей для выживших опухолевых клеток. В частности, она защищала опухолевые клетки от макрофагов и T-клеток. Сначала оставшиеся клетки находились в состоянии покоя и имели общие признаки со стволовыми клетками. Когда они попадали в другую среду, то начинали пролиферировать.
Перестройку внеклеточного матрикса стимулирует TGF-β и провоспалительные цитокины. Одновременно с BLZ95 авторы вводили мышам кортикостероид дексаметазон и малую молекулу, ингибитор TGF-βRI галунизертиб. Они не обладают противоопухолевой активностью сами по себе, но в комбинации подавляли фиброз. Это увеличивало продолжительность жизни подопытных мышей, у которых намного реже возникал рецидив.
Таким образом, терапия глиобластомы, которая воздействует на микроокружение опухоли (иммунотерапия, радиотерапия, хирургическое вмешательство), могут спровоцировать фиброз тканей. Рецидив связан с областями фиброза — они защищают оставшиеся опухолевые клетки от иммунного ответа. Снижение фиброза ассоциировано с лучшей выживаемостью у мышей и меньшим числом рецидивов.
С возрастом эстральные циклы самок млекопитающих приводят к фиброзу репродуктивных органов
Источник:
Spencer S. Watson, et al. Fibrotic response to anti-CSF-1R therapy potentiates glioblastoma recurrence // Cancer Cell (2024), September 09, 2024, DOI: 10.1016/j.ccell.2024.08.012


 Меню
Меню





 Все темы
Все темы




 0
0







