Флуоресцентные метки позволили изучить локализацию и взаимодействие 1310 белков в клетке
Ученые из США и Германии использовали генетически кодируемые флуоресцентные метки для получения данных об интерактоме эукариотических клеток. Новый подход, совмещающий прижизненную конфокальную микроскопию и масс-спектрометрию, дает дополнительную информацию о взаимосвязи функции белка с его локализацией, а также о функциях некоторых малоизученных белков.
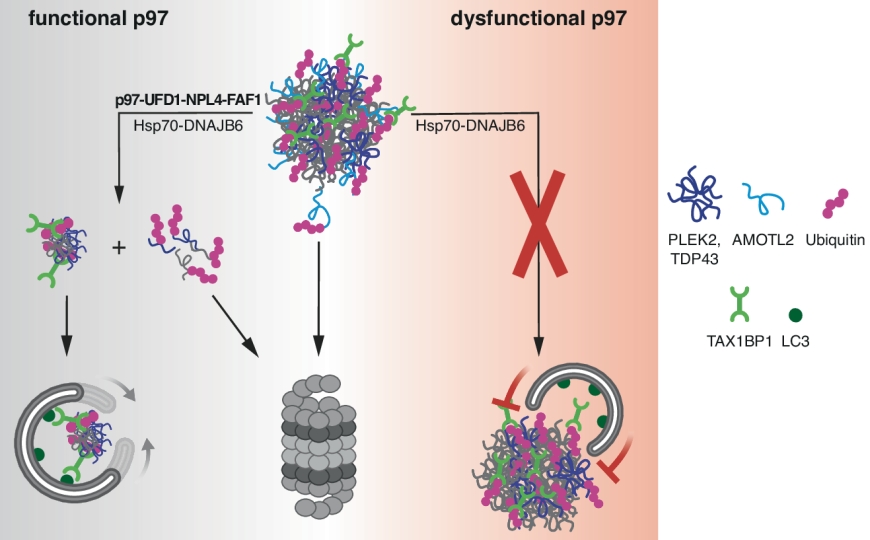
Современная биология ставит перед собой множество интересных и сложных задач, одна из которых — изучение интерактома клетки. Методы получения данных о взаимодействии белков со временем совершенствуются, ученые пытаются сделать эксперимент более быстрым и информативным. Исследователи из Германии и США предложили новый протокол для изучения межбелковых взаимодействий. Они объединили методы геномного редактирования, прижизненной конфокальной микроскопии, масс-спектрометрии и науки о данных, чтобы всесторонне изучить интерактом клеточной линии HEK293T.
Сначала ученые создали с помощью CRISPR-технологии библиотеку из 1310 клеточных линий. Каждая линия содержала ген целевого белка с флуоресцентной меткой. Ученые использовали конфокальную микроскопию для определения локализации белка, после чего клетки отправляли на иммунопреципитацию с масс-спектрометрией. В результате исследователи исключли артефакты из-за сверхэкспрессии белка и изучили его месторасположение и взаимодействие с другими белками в нативном состоянии.
Авторы валидировали построенную сеть взаимодействий и провели кластеризацию с помощью марковских моделей. В результате исследователи обнаружили несколько функциональных кластеров, благодаря которым описали свойства малоизученных белков. Так, например, они определили функцию белков NHSL1, NHSL2 и KIAA1522. Эти белки взаимодействуют со SCAR/WAVE — большим мультисубъединичным комплексом, который участвует в формировании цитоскелета. Предположительно, эти белки имеют регуляторную функцию в динамике цитоскелета.
Другой интересный результат был получен для белка ROGDI, мутации в котором вызывают синдром Кольшюттера-Тонца. Ученые обнаружили что ROGDI, наряду с белками DMXL1, DMXL2 и WDR7, взаимодействует с v-АТФазой. Дальнейший анализ показал гомологию этих белков с дрожжевыми белками комплекса RAVE, который участвует в правильном фолдинге АТФ-азы. Ученые детально проанализировали взаимодействие ROGDI, DMXL1, DMXL2 и WDR7 и пришли к выводу, что у человека существует структура с похожей функцией.
Благодаря совмещению микроскопии и масс-спектрометрии ученые смогли по-новому взглянуть на локализацию белков. Они показали, что кластеризация на основе паттернов местоположения белка отражает функциональные закономерности. Так, например, они смогли дифференцировать различные белки везикулярного транспорта, несмотря на их схожую локализацию.
Взаимодействующие белки с низкой стехиометрией не всегда локализуются в одном месте. Но белки с высокой стехиометрией, которые взаимодействуют в строгих пропорциях, обычно колокализуются.
Исследователи разделили свои данные на три фракции, отражающие функциональную и пространственную организацию белков. Одна из фракций была обогащена РНК-связывающими белками. Интересно, что эти белки имели свои паттерны локализации, образуя своеобразные «микрокомпартменты» в клетке.
Результаты исследования открывают новые возможности для характеристики малоизученных белков, высокопроизводительного скрининга и анализа клеток in vivo, в том числе в ходе заболеваний.


 Меню
Меню





 Все темы
Все темы




 0
0