Галина Клинк: «Эволюция вирусов — циклический и бесконечный процесс»
Откуда взялись вирусы? Почему они так любят «желейные рулеты»? Как бороться с вирусами с помощью мутагенеза? Чем рекомбинация отличается от реассортации? Болеют ли свиньи птичьим гриппом? Можно ли предсказать, какой вариант вируса станет «успешным»? Ответы на множество вирусологических вопросов дала Галина Клинк в лекции «Поняв прошлое, узнать будущее? Эволюция вирусов и ее предсказуемость», которая состоялась 26 сентября в рамках лектория «Метафаза» в Парке «Зарядье».

Вирусы очень разнообразны. Они отличаются по форме вирусных частиц, кругу хозяев, типу кодирования генетической информации, размеру и кодируемым генам. Длина генома вирусов различается на несколько порядков, как и размер частиц. Самые маленькие, такие как геномы цирковирусов, — длиной около 2000 нуклеотидов и кодируют всего два гена. Самые большие вирусы, например, мимивирус, имеют геном длиной более 1 миллиона нуклеотидов и кодируют около 1000 белков (человеческий геном кодирует около 20000). Вирусоподобные частицы, такие как вироиды, не являются полноценными вирусами, поскольку представляют собой просто инфекционную молекулу РНК, не покрытую белковой оболочкой. Однако, если рассматривать их как вирусы, разброс становится еще сильнее — например, длина генома вироида латентной мозаики персика — всего около 400 нуклеотидов, и он не кодирует ни одного белка.
Для изучения этого огромного разнообразного исследователи стараются систематизировать вирусы. В 1966 году на конгрессе микробиологов в Москве было решено создать Международный комитет по таксономии вирусов, который собирается каждый год для решения вопросов о классификации. Любой человек может открыть новый вирус и предложить свое название для него. Систематика вирусов крайне несовершенна из-за их огромного разнообразия. Если клеточные организмы можно объединить в одно эволюционное дерево, то для вирусов такое сделать невозможно. Их разнообразие скорее напоминает лес, состоящий из эволюционных кустов и деревьев.
Существуют три основные гипотезы происхождения вирусов. Первая гипотеза — доклеточная — предполагает, что вирусы возникли раньше клеток в первичном бульоне, в мире первичных репликаторов (протоклеток), которые еще не были похожи на современные клетки. Вторая гипотеза утверждает, что вирусы произошли из протоклеток, которые деградировали и стали паразитировать на настоящих клетках. Согласно третьей гипотезе (гипотезе побега), вирусы произошли из частей генома клетки, которые смогли его покинуть, обрели белковую оболочку и остались частично зависимыми от клеток и не могут без них провести свой жизненный цикл.
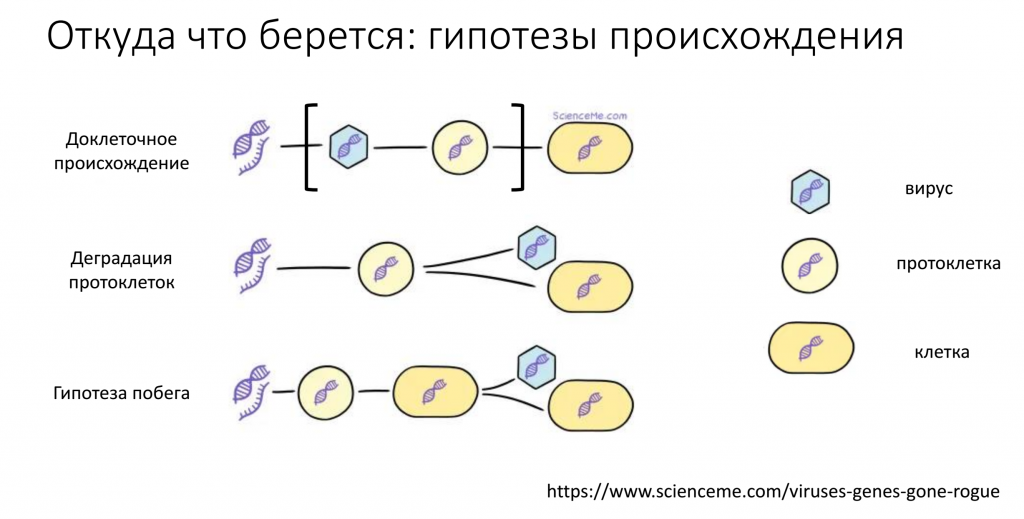
По мнению Галины Викторовны, верны все три гипотезы. Огромное разнообразие вирусов показывает, что они возникали несколько раз и по различным механизмам. Интересно, что многие белки оболочки вирусов, скорее всего, произошли от каких-то клеточных белков, например, самой популярной укладкой капсидных белков является структура под названием «желейный рулет». Такую структуру имеют не только вирусные, но и многие клеточные белки. Примечательно, что многие из этих белков могут взаимодействовать с сахарами. Для вируса захватить такой клеточный белок и использовать его для построения своей оболочки было бы очень выгодно — он будет легко связываться с сахарами на поверхности клеток, способствовать стыковке вируса с клеткой и проникновению внутрь. Другой аргумент в пользу приобретения капсидных белков из клеточных — такие белки способны при определенных условиях собираться в вирусоподобные структуры.
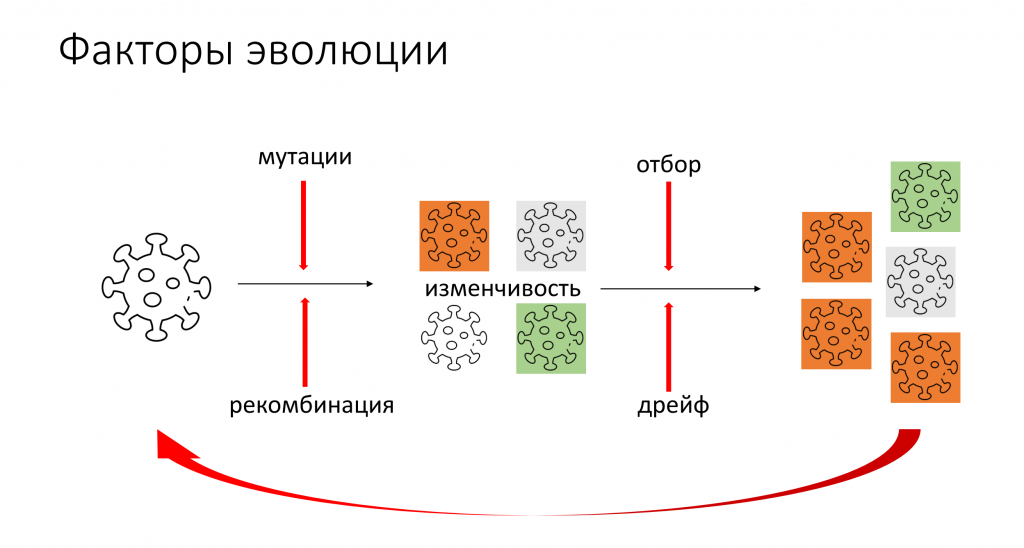
Далее Галина Викторовна перешла от древней и таинственной части эволюции вирусов к той, которая происходит на наших глазах. Эволюции нужна изменчивость, то есть вариативность признаков. Она создается за счет мутаций и рекомбинации. Из пула разных вирусов под действием естественного отбора выживают те, которые имеют определенные характеристики, подходящие для сложившихся условий.
В действие отбора, который является направляющим фактором эволюции (именно благодаря ему эволюция может быть в какой-то степени предсказуема), вмешивается случайность. Эволюционные биологи называют эту случайность дрейфом. Из нескольких вирусов, которые одинаково хороши с точки зрения отбора, одни могут погибнуть, а другие, наоборот, успешно размножаться. Эволюция — циклический, бесконечный процесс, все эти факторы действуют снова и снова в течение инфекции и в течение многих лет существования вирусов в популяции человека.
Первый важный фактор, создающий изменчивость, — появление мутаций. Скорость возникновения новых мутаций сильно варьирует у разных вирусов. Вирусы хорошо вписываются в общий для живых систем тренд — отрицательную корреляцию между длиной генома и скоростью мутирования. Большие геномы не могут позволить себе быстро мутировать, потому что в этом случае в них будет накапливаться слишком много ошибок. Большие вирусы кодируют ферменты, которые исправляют ошибки их полимераз. А некоторые вирусы вообще не кодируют свои собственные ДНК-полимеразы и пользуются клеточными, которые очень точны. Но на другой части распределения есть очень быстро мутирующие вирусы. Самый быстрый из них — вироид хлоротической пятнистости хризантемы. У него каждый новый образующийся в ходе репликации вирусный геном содержит в среднем одну мутацию.
Не только вироиды мутируют быстро, но и РНК-вирусы. Ученые показали, что достаточно увеличить скорость мутирования РНК-вирусов в 3-5 раз, чтобы их популяция вымерла просто из-за накопления вредных мутаций. Так возникла идея о лечении заболеваний, связанных с РНК-вирусами, с помощью летального мутагенеза. Это работает примерно так: берется аналог природного нуклеотида, который РНК-полимераза может посчитать за два разных нуклеотида, например, за цитидин или уридин. Такой «мигающий» нуклеотид вызывает ошибки в процессе репликации и вносит мутации. Самый знаменитый, самый новый и самый эффективный препарат такого действия — молнупиравир. Он показал большую эффективность в лечении инфекции SARS-CoV-2. В США и Великобритании это лекарство одобрено для лечения тяжелых случаев COVID-19.
Галина Викторовна отметила, что не ученые первыми догадались применять летальный мутагенез против РНК-вирусов, а природа. У нас в клетках есть белки семейства APOBEC, которые превращают цитозин в тимин и тоже вносят мутации в геном вирусов. Эти ферменты помогают в борьбе с ротавирусами, но не без проблем. Оказалось, что во многих опухолях мутации происходят из-за активности этих ферментов, призванных нас защищать.
Другой важный механизм приобретения вирусами изменчивости — рекомбинация. Это обмен участками между гомологичными хромосомами. В результате образуются химерные хромосомы, которые содержат наборы генов, характерных для обеих предковых хромосом. Новые комбинации генов создают вирусы с новыми свойствами. Если мы рассматриваем мутации как эволюционные шаги, то события рекомбинации больше похожи на эволюционные прыжки.
Один из самых быстро рекомбинирующих вирусов — ВИЧ. У него существует около 60 известных циркулирующих рекомбинантных форм, и сейчас рекомбинанты составляют около 20% от всех инфекций. Рекомбинация ВИЧ частично предсказуема. Точки рекомбинации в геноме ВИЧ распределены не случайно. Кроме того, вероятность событий рекомбинации снижается с эволюционным расстоянием: внутри одного подтипа рекомбинация происходит очень часто, но между разными подтипами ее частота в несколько раз ниже.
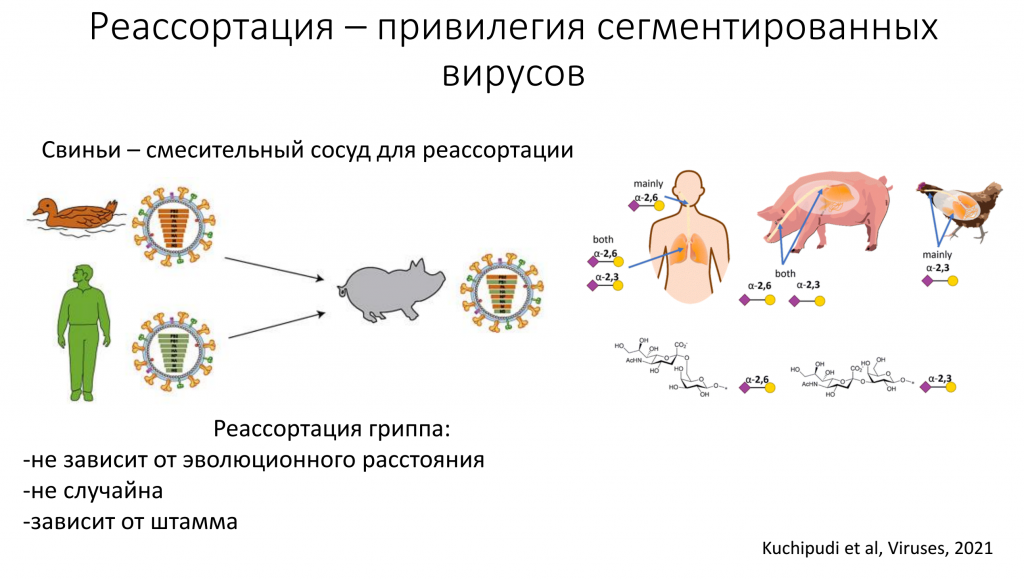
Вирус гриппа, в отличие от ВИЧ, очень мало пользуется рекомбинацией. Его геном сегментирован состоит не из одной хромосомы, а из нескольких сегментов, и каждый из них кодирует разные белки. Поэтому вирус может накапливать изменчивость быстро за счет реассортации — обмена сегментами между двумя вирусами. Все известные штаммы, которые вызывали пандемию гриппа (например, в 2009 году), являются реассортантами и содержат участки геномов разных вирусов гриппа, которые заражают человека, птиц и свиней.
Для реассортации два вируса должны заразить один организм и встретиться в одной клетке. Птичий грипп очень редко заражает людей, поскольку рецепторы, с которыми связываются вирусы, у человека, представлены в нижних дыхательных путях. Вирусу тяжело до них добраться. Если человек все-таки заразился птичьим гриппом, ему сложно передать этот вирус другим людям. Человеческие вирусы гриппа взаимодействуют с рецепторами, которые расположены в верхних дыхательных путях. А вот у свиней в верхних дыхательных путях есть и те, и другие рецепторы — они одинаково хорошо заражаются и птичьим, и «человечьим» гриппом. Есть большая вероятность, что в верхних дыхательных путях свиней и произойдет реассортация.
У вирусов гриппа реассортация не зависит от эволюционного расстояния между ними. Но она неслучайна, так как какая-то часть генома обязательно должна прийти из одного вируса, а какая-то — из другого. Неслучайна и упаковка генома у такого сложного сегментированного вируса. Каждый упаковывающийся сегмент генома содержит сигнал для упаковки следующего. Если сигналы между ними сильно отличаются, то непохожий сегмент не будет упакован. Также реассортация зависит от штамма. Некоторые штаммы вируса могут часто реассортировать, а другие по каким-то причинам лишены этой способности.
Реассортация, рекомбинация и мутации создают огромный пул изменчивости вирусов — материал для отбора. Одним из сильнейших факторов отбора для вирусов является иммунитет.
Галина Викторовна рассказала о борьбе вирусов с врожденным иммунитетом. Например, вирус гриппа борется с белком MxA (белок устойчивости к миксовирусу). По названию понятно, что он защищает нас не только от вируса гриппа. Этот белок собирается в полимерные кольца, которые «запирают» вирусный полимеразный комплекс и не дают ему функционировать. Если белок MxA хорошо работает, то человек не заражается вирусом — он попадает в клетку, но дальше ничего не происходит. Человеческий грипп научился справляться с этим белком, но от птичьего гриппа он может защитить. Однако те штаммы птичьего гриппа, которым удалось заразить людей, имеют мутации, которые помогли вирусу справиться с этим белком, например, мутации в белке нуклеокапсида (оболочки, в которую заключен вирусный геном) или в факторе вирулентности NS1. Этот белок является антагонистом интерферона, которым как раз и активируется MxA.
Другой важный фактор давления на вирусы — лекарственные препараты. В конце 1980-х годов была введена антиретровирусная терапия ВИЧ-инфекции, но первые препараты давали эффект очень ненадолго — вирус приобретал устойчивость за счет единичных мутаций. Тогда придумали лечить вирус тройными препаратами: три лекарства действуют на разные белки вируса. Такая терапия очень эффективна, и люди могут надолго уйти в ремиссию. Но достаточно часто к такой терапии вирус тоже приобретает устойчивость, причем через годы успешного лечения. Это может произойти, когда человек пропускает прием препарата или разные лекарства с различной эффективностью проникают в разные ткани и образуются локальные устойчивые популяции вируса в разных частях тела.
Огромное влияние на эволюцию вирусов имеет случай — дрейф. Одним из вариантов может быть так называемое суперраспространение. Разброс по количеству людей, которых заразит один инфицированный человек, для разных вирусов различается. Например, для вируса гриппа, вызвавшего пандемию в 2009 году, он был очень маленьким: каждый инфицированный вызывал примерно одно и то же количество вторичных инфекций. Для коронавируса картина другая. Большинство людей никого не заражают, но при этом существует пул людей, которые заражают большое количество человек — 15 % больных создают 80% вторичных инфекций. Суперраспространение – это когда один человек или группа людей, которые заразились на каком-то мероприятии, становятся источником распространения вируса в популяции.
Галина Викторовна и ее коллеги изучали вспышку, вызванную вариантом омикрон в студенческом общежитии в Санкт-Петербурге в начале 2022 года, когда он только появился в России. В тот период все случаи были завозными, но специалисты нашли вспышку омикрона внутри России. Потомки этого штамма потом были обнаружены во многих регионах России и даже в соседних странах. Интересно, что ни одного потомка этого штамма не было найдено в Москве.
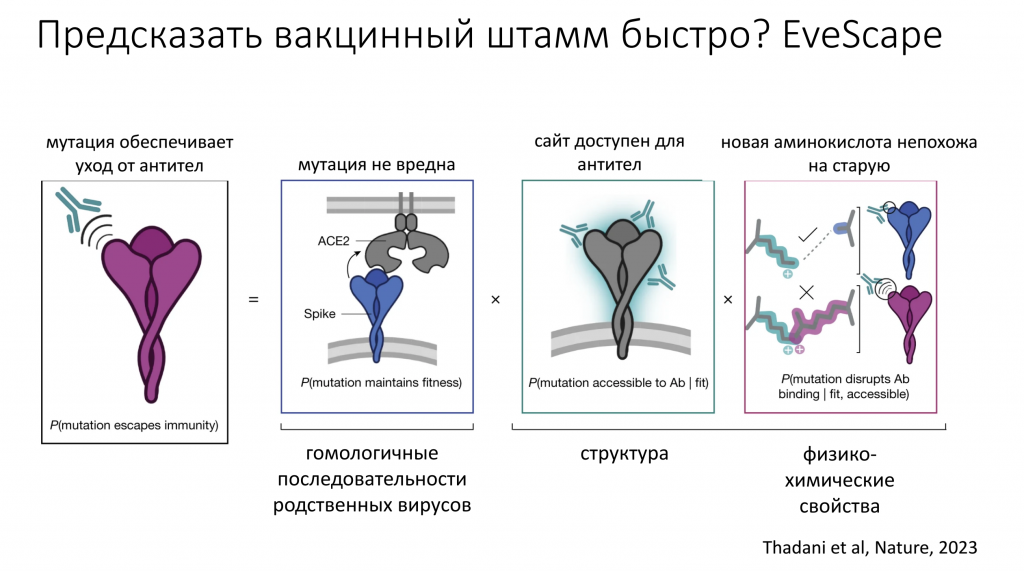
Галина Викторовна объяснила, как ученые прогнозируют эволюцию вирусов. Они создают предсказательную модель, в которую вносят самые разные типы информации о вирусах. Это могут быть сведения о ходе эпидемии в нынешнем сезоне, о том, какие линии и генотипы наиболее распространены, а какие вымирают, данные о частоте мутаций, структурах белков, родственных вирусах и результаты экспериментов по внесению искусственных мутаций в геном. К этой информации добавляются предположения модели, и на основании всего этого с помощью разных алгоритмов можно рассчитать, какой штамм будет циркулировать в следующем сезоне.
Докладчица отметила, что любая модель является упрощением, и поскольку эволюция вирусов достаточно сложна, упрощать приходится достаточно сильно. В качестве примера такой модели она привела EveScape, которая позволяет очень точно предсказать последовательности успешных штаммов коронавируса, не имея никакой информации о нынешнем коронавирусе, а только о его родственниках – сезонных коронавирусах человека и вирусах животных.

Вирусная популяция существует в двух «ипостасях». С одной стороны, популяция вирусов формируется внутри одного пациента, особенно если человек болеет долго: появляется изменчивость, действуют факторы отбора и случайности внутри одного организма. С другой стороны, существует глобальная популяция вирусов, которые от одного зараженного человека передаются другим. Отличным примером обоих случаев служит ВИЧ. Различия в характере эволюции этих двух «ипостасей» можно заметить даже по виду филогенетических деревьев. Это отличие может быть связано с тем, что вирус вероятнее всего передается в острой фазе инфекции, до того, как прошла его многолетняя эволюция в организме пациента. Таким образом, передается вирус, близкий по своим свойствам тому, которым заразился человек, и в результате получается, что глобальная эволюция идет медленнее.
В заключение Галина Викторовна подчеркнула, что вирусы дали человечеству много положительного. Основные знания о важнейших клеточных процессах были получены на бактериофагах — вирусах бактерий. Вирусы дали нам обратную транскриптазу, которая используется в науке и биотехнологиях. Они могут служить хорошими средствами доставки лекарств или вакцин в клетки. Бактериофаги сами являются лечебным средством, представляющим интерес на фоне появления антибиотикорезистентных бактерий.
Вопросы слушателей прежде всего относились к реассортации. Является ли она редким событием или происходит часто? Бывает ли реассортация между очень разными штаммами одного вида? Галина Викторовна объяснила, что у вирусов с сегментированным геномом она происходит очень часто. Реассортация зависит от того, насколько подходящие друг другу штаммы встретились, причем не обязательно эволюционно близкие. Чтобы реассортация произошла, нужнабольшая концентрация вирусов. Например, штаммы птичьего и человеческого гриппа не реассортируют в птицах или людях, а только в свиньях, потому что накапливаются в их организме в достаточном количестве. У одного пациента реассортация может происходить множество раз. В результате возникает не один новый вирус, а пул реассортантов, содержащих разные комбинации геномов исходных вирусов, а потом за дело берется отбор, который отфильтровывает только самые живучие из них, которые смогут заражать соседние клетки.
Слушателей также интересовал вопрос, может ли вирус внезапно сменить специализацию, например, из вируса растений стать вирусом человека. Действительно, практика последних лет говорит о том, что новый вирус может прийти внезапно, но вероятность перехода с цветов на человека крайне низка, ответила Галина Викторовна. Однако есть вероятность того, что птичий грипп начнет передаваться между людьми и вызовет пандемию, поэтому специалисты постоянно мониторят основные зоонозные источники гриппа. Создана даже экспериментальная вакцина против вируса птичьего гриппа на такой случай. Правда, возможно, когда это произойдет, она уже устареет, так как вирус эволюционирует очень быстро.
На вопрос о соотношении вклада дрейфа и отбора в эволюцию вирусов Галина Викторовна ответила, что чем больше популяция вируса, тем большую роль в ней будет играть отбор и меньшую — случайные процессы (дрейф). Но все вирусы рано или поздно проходят через «бутылочное горлышко», когда популяция резко сокращается, и основную роль играет уже не отбор, а дрейф. Такое происходит, например, при передаче ВИЧ от человека к человеку, когда может передаться одна единственная вирусная частица, и совсем необязательно это будет наиболее успешный вирус из тех, что есть в организме человека. Вирусы могут быть неравномерно распределены по организму и существовать маленькими локальными популяциями, в которых ослабляется отбор и превалирует дрейф. При этом будут накапливаться мутации, которые по отдельности вредны для вируса, но вместе дают ему конкурентное преимущество. Так произошло с вариантом коронавируса омикрон — его S-белок содержит несколько десятков мутаций, которые помогают ему лучше взаимодействовать с клеточным рецептором и скрываться от антител. Но они не смогли бы накопиться по одной, так как каждая по отдельности вредна для вируса. Скорее всего, они постепенно возникали в организме пациента с ослабленным иммунитетом, который долго болел коронавирусом.


 Меню
Меню





 Все темы
Все темы



 0
0







