Гелина Копеина: «Без клеточной гибели терапия рака не сработает»
Новый лекционный блок научно-просветительского проекта «Метафаза» от PCR.NEWS и парка «Зарядье» открыла Гелина Копеина. Она рассказала о тонко регулируемом балансе клеточной гибели и регенерации, а также о том, куда исчезает 90% наших лимфоцитов, что такое рецепторы смерти, почему опухолевые клетки стремятся к гибели, как связаны ферменты апоптоза с прозрачностью хрусталика глаза, и что может помешать регенерации лапки саламандры.

Гелина Копеина, доктор биологических наук, руководитель лаборатории механизмов программируемой гибели клеток в Институте молекулярной биологии им. В.А. Энгельгардта РАН и ведущий научный сотрудник факультета фундаментальной медицины МГУ, выступила с лекцией «Программируемая гибель клеток в норме и патологии».
Гибель случайная, регулируемая и программируемая
Клетки в нашем организме размножаются и гибнут, и между этими двумя состояниями есть баланс. Если баланс нарушается, это опасно. Так, например, если идет слишком интенсивная клеточная гибель и недостаточная пролиферация, то возникают нейродегенеративные заболевания, некоторые заболевания крови. При недостаточной клеточной гибели и слишком сильной пролиферации клетки аккумулируются, возникают онкологические заболевания.
Докладчица начала свой рассказ с классификации клеточной гибели. Она может быть случайной: человек порезался, получил химическое или тепловое повреждение, клетки в поврежденном участке погибли. В этом случае они погибают по типу некроза, то есть просто разрываются, и все их содержимое оказывается в окружающей ткани.
Есть регулируемая клеточная гибель, управляемая специальными молекулами внутри клетки. Но это тоже не является нормой.
И есть программируемая гибель клеток, когда ответственные за нее белки обеспечивают гибель в ответ на определенные стимулы, в том числе на специальные лиганды. Эти процессы необходимы для нормального развития организма. Самый известный тип программируемой клеточной гибели — это апоптоз.
В принципе, все типы гибели клеток можно морфологически разделить на апоптотические и некротические. При некротической гибели клетка разбухает и разрывается. При апоптотической, наоборот, клетка конденсируется, все ее содержимое включается в так называемые апоптотические тельца и ничего не выходит наружу. В норме клетки главным образом погибают по апоптотическому типу, поэтому в норме воспаления нет.
На сегодня известно как минимум 10 различных типов гибели клеток.
Зачем вообще нужен апоптоз в организме? В первую очередь клетки погибают, когда они выполнили свою функцию, или потому, что они повреждены. Так, 90% наших лимфоцитов не выходят из тимуса, потому что, когда лимфоцит созревает, его проверяют, не умеет ли он опознавать собственные белки организма, и если он это умеет, его убивают. Когда этого не происходит, развивается аутоиммунное заболевание.
Клетки костного мозга постоянно обновляются, и если бы они не умирали через апоптоз, то у человека за 70 лет выработалось бы три тонны клеток. Другой подобный пример — эпителий кишечника, который постоянно погибает по апоптотическому механизму.
Насколько важна роль программируемой гибели в терапии опухолевых заболеваний?
На самом деле опухолевые заболевания очень сильно отличаются друг от друга. Но, как отмечается в известной публикации 2022 года «Hallmarks of Cancer: New Dimensions», у них есть 14 общих признаков. Есть лекарства, которые могут воздействовать на отдельные признаки. Но если при терапии не работает клеточная гибель, то терапия не будет эффективной.

В XXI веке три Нобелевские премии были выданы за открытие основных механизмов апоптоза, аутофагии и иммунологической гибели клеток.
Каспазный каскад
«Апоптоз» переводится с греческого как «опадание листьев». Но к этому процессу он не имеет никакого отношения. В растениях нет апоптоза, там нет главных его участников — ферментов каспаз.
Когда приходит сигнал гибели клетки, на первой стадии активируются инициаторные каспазы, далее активируются эффекторные каспазы и происходит разрезание клеточных структур. Следующий этап — блебинг мембраны, то есть формирование апоптотических телец, в которые включаются содержимое клетки, в том числе остатки ядра. В дальнейшем эти частички съедаются клетками-соседями или макрофагами.
Ферменты каспазы — это основные участники апоптоза. Они подразделяются на инициаторные и эффекторные — начинающие процесс и завершающие его.
Сигнал гибели активирует каспазы в специальных комплексах (обычно они неактивны). Каспаза-8 и каспаза-2 активируют другую инициаторную каспазу-9, она, в свою очередь, активирует эффекторные каспазы-3, 6, 7, которые имеют огромное количество субстратов в клетке и разрезают все клеточные структуры, что и приводит к деградации.
Есть два типа запуска апоптоза. Внешний путь, или рецепторный, активируется через специальные рецепторы смерти на клетках. И если с ними связываются лиганды, то происходит формирование комплекса, где активируется каспаза-8. Она или напрямую активирует эффекторные каспазы, или активирует внутренний путь апоптоза, расщепив блок Bid. Этот внутренний путь апоптоза регулируется семейством белков BCL2.
Вообще, запустить апоптоз не так просто. Для регуляции его запуска целое семейство белков BCL2 (на сегодня известно о 32) в норме блокирует друг друга. Таким образом, помимо проапоптотических белков, которые запускают гибель клетки, есть антиапоптотические белки, которые ей препятствуют.
Когда приходит сигнал на рецепторы смерти, проапоптотические белки активируются, а антиапоптотические блокируются. Два эффектора — белки BAX и BAK — олигомеризуются и образуют пору во внешней мембране митохондрии. Из межмембранного пространства выходит белок цитохром С, обычно участвующий в дыхании. При запуске клеточной гибели цитохром С собирает комплекс, который называется «апоптосома». Именно в нем активируется каспаза-9.
Активированные эффекторные каспазы разрезают транскрипционные факторы, трансляционные факторы, структурные белки. Кроме того, они разрезают белок ICAD, блокирующий нуклеазу. Активная нуклеаза транслоцируется в ядро и начинает разрезать ДНК, распадается генетический генетический материал клетки. Происходит конденсация хроматина и образование апоптотических телец.
Регуляторы апоптоза
Очевидно, что апоптоз должен хорошо контролироваться, чтобы он не запускался тогда, когда не надо, и запускался, когда надо. Первый уровень контроля — генетический.
Хорошо известен белок p53, онкосупрессор и защитник нашего генома. Он активируется в основном при повреждениях ДНК. На самом деле у p53 множество функций — уже выявлены сотни его таргетов. При повреждениях ДНК он останавливает деление клетки, а после этого может активировать репарацию ДНК. Кроме того, он запускает процесс апоптоза и регулирует метаболизм. Практически в 50% случаев заболеваний тем или иным раком обнаруживается мутация в гене p53. Если у мышей этот белок выключить генетическими методами, то все такие мыши заболевают раком. Сегодня при некоторых заболеваниях делаются генетические тесты для определения статуса этого белка.
Гелина Копеина рассказала о работе, которая была проделана в ее лаборатории. Если взять опухолевые клетки, устойчивые к определенной терапии, то в гене, кодирующем p53, может обнаружиться мутация, приводящая к замене гистидина в положении 193 на аргинин. С помощью молекулярного моделирования авторы работы определили, что эта мутация изменяет связывание p53 с ДНК, а именно взаимодействие p53 с ДНК запускает экспрессию проапоптотических генов. Эта мутация обнаруживается в разных типах опухолей. Белок с такой заменой не полностью теряет свою функцию, но его работа ухудшается. У мышей опухоль с такой мутацией растет быстрее, чем без мутации, и она хуже реагирует на терапию. Определение мутаций в белках, которые на генетическом уровне управляют апоптозом, помогает понять, насколько будет эффективна терапия и каков будет прогноз для пациента.
Следующий уровень регуляции апоптоза — это антиапоптотические белки семейства BCL2.
Антиапоптотические белки все время взаимодействуют с проапоптотическими белками и блокируют друг друга. Одна из подгрупп проапоптотических белков называется BH3-only. BH3 —домен, через который проапоптотический белок взаимодействует с антиапоптотическим через специальную «канавку» последних; соответственно, если какое-то вещество сможет встроиться в эту «канавку», то проапоптические белки высвободятся и запустят апоптоз.
Ученые создали такое низкомолекулярное вещество — BH3-миметик (химический аналог BH3-домена), который можно вводить в организм. В 2016 году были одобрены для применения первые лекарства этого класса, например, венетоклакс. Но он блокирует только одного из членов семейства — белок BCL2; есть другие члены семейства, например, MCL1. Ведутся работы и с другими белками. Блокировка должна быть селективной, потому что если заблокировать все члены антиапоптотического семейства, то клетки начнут бесконтрольно погибать, и лечение будет давать очень тяжелые побочные эффекты.
Как мы можем определить, кому из пациентов стоит назначать такие лекарства, а кому не стоит? Команда докладчицы выращивала клетки разных типов опухолей в присутствии блокатора белка MCL1. Оказалось, что на такое воздействие отвечают только те клетки, у которых низкое содержание белков Bcl-xL и и высокое Bak.
Потом они взяли ткани пациентов с аденокарциномой легкого и проанализировали, как изменяются уровни анти- и проапоптотических белков семейства BCL2 относительно нормальной ткани. Выяснилось, что в опухолях снижены уровни антиапоптотических белков и повышены уровни проапоптотических белков. Есть такое явление, как прайминг опухолевых тканей к гибели: опухолевые клетки стараются защититься от гибели, накапливая молекулы, которые позволяют им это делать, но в качестве компенсации возрастает количество других молекул, которые способствуют гибели. Аналогичный паттерн авторы обнаружили, проанализировав открытые данные Атлас ракового генома (TCGA).
Дальше исследователи проанализировали, у пациентов с каким профилем будет лучше всего прогноз. Выяснилось, что большое количество проапоптотического белка BAK и низкое количество MCL1 и Bcl-xL — предиктор хорошего прогноза по выживаемости и эффективности BH3-миметиков.
Некроптоз и аутофагия
Следующий вид клеточной гибели — некроз, неконтролируемый или контролируемый. К контролируемому некрозу можно отнести некроптоз.
Две киназы, RIPK1 и RIPK3, запускают некроптоз. Сначала RIPK1 активируется в специальном комплексе, потом он активирует киназу RIPK3, которая, в свою очередь, активирует белок MLKL. MLKL формирует поры, встраиваясь во внешнюю мембрану, вода проникает внутрь благодаря осмосу, и клетку разрывает.
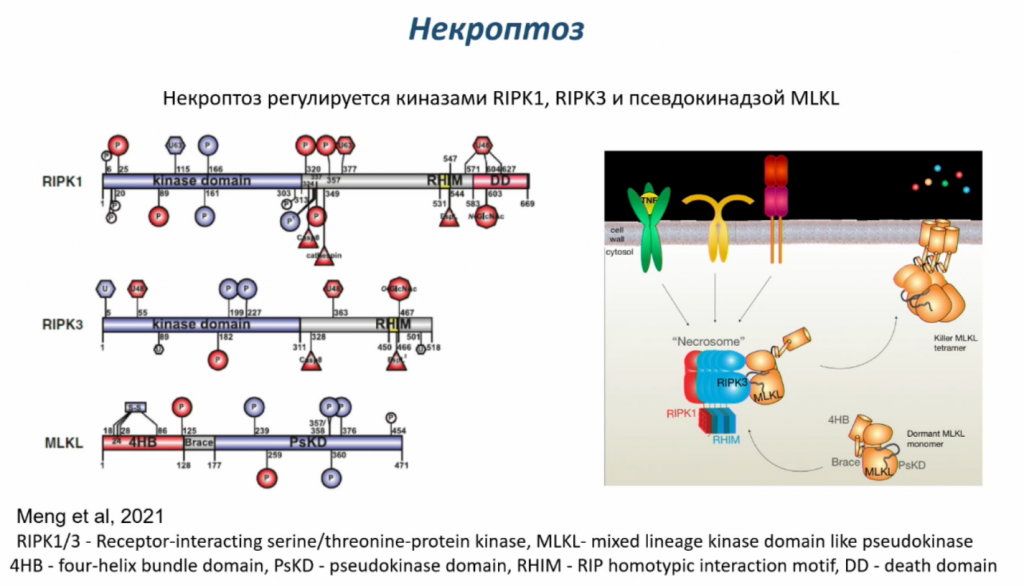
Некроптоз можно запустить через те же рецепторы смерти, что и апоптоз, но только в определенных условиях. Когда на рецептор приходит сигнал, формируется комплекс, содержащий каспазу 8, которая инициирует апоптоз. Ее можно заблокировать, например, химически. Но в организме чаще бывает, что в каспазе 8 есть мутация, которая не дает ей работать. И вот тогда формируется некросома, где активируется MLKL, формируется пора, клетку разрывает.
Есть и внутренний путь некроптоза. Так, при повреждениях ДНК, если не работает апоптоз, например, потому что он заблокирован в опухолевых клетках, может запуститься некроптоз через сборку комплекса Ripoptosome.
Некроптоз в организме в норме запускается не так уж часто. Но если идет постоянный стресс, повреждения или инфекции, это может произойти. Когда выходит наружу содержимое разорванной клетки, оно несет некую информацию окружающим клеткам; вышедшие из клетки молекулы называются damage-associated molecular patterns (DAMP). Иммунная система активируется, это приводит к воспалению. Известно, например, что этанол и жирная еда могут провоцировать некроптоз, который может привести к циррозу печени, а цирроз печени может переродиться в гепатоцеллюлярную карциному.
Аутофагия практически всегда идет в каждой клетке. Удаление поврежденных структур, не приводящее к гибели самой клетки — это нормальный процесс. Еще аутофагия происходит при нехватке энергии.
В начале этого процесса определенные киназы снимают «стоп» с аутофагии, затем формируются комплексы, которые способствуют тому, что из эндоплазматического ретикума формируется двухмембранная структура, которая начинает расти и в конце концов превращается в пузырек. В этот пузырек забрасывается то, что не нужно клетке, далее эта аутофагосома сливается с лизосомой, ферменты которой переваривают содержимое.
Сенесценция и митотическая катастрофа
Повреждение ДНК может привести к гибели клетки — некроптозу, апоптозу. — или же к возникновению состояний, которые гибелью не являются, но могут быть предстадиями гибели, таким как senescence, или клеточное старение. Сенесцентные клетки выпускает в окружающую среду молекулы, которые стимулируют размножение соседних клеток. Появление таких клеток для опухолевых заболеваний — это нехорошая ситуация, потому что она стимулирует размножение опухолевых клеток.
Другое подобное состояние — митотическая катастрофа. Возникает оно при повреждении ДНК и работает как противоопухолевый механизм, не позволяя накопиться клеткам с необратимо поврежденной ДНК. Митотическую катастрофу можно опознать морфологически: ее признаки — макронуклеация, микронуклеация, возникновение нескольких ядер или нескольких центросом.
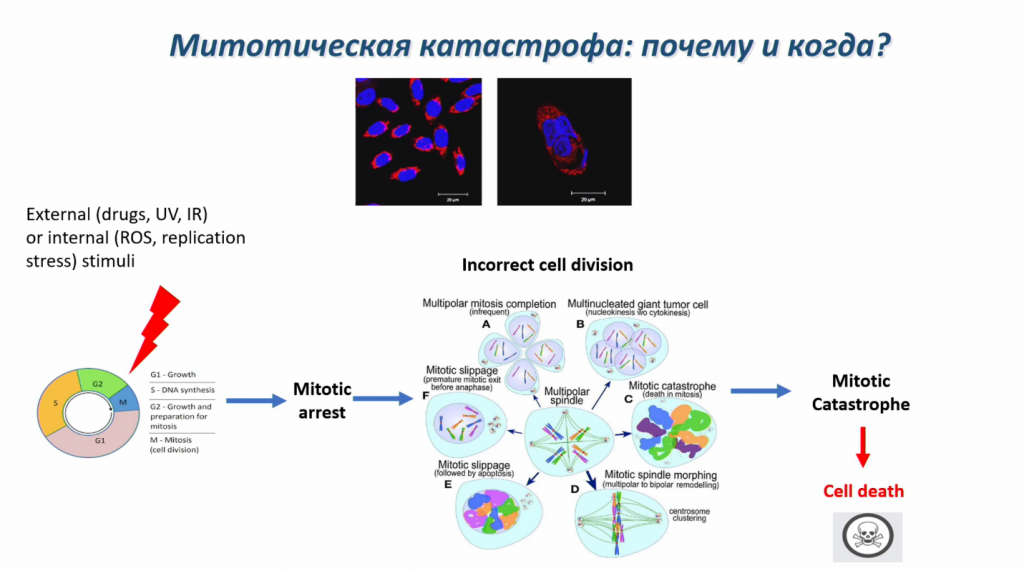
Научная группа Гелины Копеиной посмотрела, как клетка может погибнуть из митотической катастрофы. При этом состоянии в клетке повышается количество активных форм кислорода, и если заблокирован апоптоз, то клетка уходит в аутофагию — точнее, использует свой аутофагический аппарат, чтобы запустить гибель. Если же в клетке заблокировать и апоптоз, и аутофагию, она погибнет по некроптозу.
Важно понять, каким образом идет переключение между разными типами гибели при митотической катастрофе, потому что уже сегодня есть препараты, которые запускают именно ее, например, таксаны.
Гибель — сигнал начать регенерацию
Гибнущие клетки сообщают окружающим клеткам о том, что они погибли и нужно как-то восстановить ткань. При этом может быть запуститься, например, размножение уже дифференцированных специализированных клеток; может пролиферировать и дифференцироваться стволовая клетка; в некоторых случаях может происходить репрограммирование уже дифференцированных клеток.
Различают нормальную регенерацию и регенерацию после повреждений: в первом случае нет воспаления, во втором есть. В тот момент, когда произошло повреждение, то есть очень быстрый, существенный выброс содержимого клеток, — воспаление помогает, привлекает определенные иммунные клетки, способствует восстановлению ткани, ее структуры. А если воспаление хроническое, тогда оно подавляет регенерацию.
Как умирающие клетки способствуют регенерации ткани? При апоптозе есть четыре разных механизма. Это высвобождение определенных молекул, которые способствуют пролиферации соседних клеток. Например, каспаза-3 активирует фосфолипазу 2, которая помогает производить простагландин Е, стимулирующий размножение клеток.
Также клетки выпускают экстрацеллюлярные везикулы, содержащие отдельные белки, ДНК, некоторые некодирующие РНК, и это стимулирует так называемый Wnt-каскад, которые способствуют пролиферации.
Кроме того, умирающая апоптозом клетка через свою мембрану выпускает низкомолекулярные вещества, такие как спермидин, гуанозин монофосфат и инозин монофосфат. Эти низкомолекулярные вещества немного снижают воспаление и опять же усиливают клеточную пролиферацию.
Четвертый механизм — высвобождение пространства. Клетки постоянно находятся в контакте, и при разрушении клетки у соседних изменяется конформация.
Каспазы, которые участвуют в апоптозе, выполняют и неапоптотические функции. Например, каспаза-3 удаляет ядра из клеток глазного хрусталика, чтобы тот был прозрачным. Каспаза-14 расщепляет белок филаггрин — продукт его расщепления ответственен за то, чтобы наша кожа была эластичной и увлажненной.
Еще один момент — регуляция полиплоидности клеток. Клетки разных органов размножаются с разной скоростью. Например, клетки печени размножаются достаточно быстро, считается, что за 6–8 месяцев печень обновляется практически полностью. Нужно следить за тем, чтобы при такой быстрой пролиферации не было умножения генетического материала, то есть полиплоидности. Этим занимается каспаза-2.
Свою роль в регенерации играет и аутофагия. Она в основном работает в тканях, которые регенерируют медленно, например, в головном мозге. Если в них повредится какая-то структура, то они удаляются с помощью аутофагии, возникают новые структуры.
Когда при некротических формах гибели содержимое клетки оказывается снаружи, оно также стимулирует иммунную систему для усиления регенерации. Например, один из важных известных белков DAMP, HMGB1, активирует важные киназы, которые усиливают пролиферацию. АТФ погибшей клетки — тоже компонент DAMP, и он через определенные рецепторы подает сигнал макрофагам: «найди меня». Макрофаги приходят и съедают остатки клеток. Макрофаги очень важны для регенерации. Если удалить эти клетки из раневой поверхности саламандр, то конечность у них не регенерирует.
Стволовые клетки дают начало новым клеткам и позволяют ткани регенерировать. Оказывается, что стволовые клетки очень устойчивы к гибели, но по мере того, как они размножаются, дифференцируются, чувствительность к гибели возрастает. Так, считается, что стволовые клетки жировой ткани живут не менее 10 лет, а обычная жировая клетка — 5–6 лет.
Появились терапевтические подходы, использующие стволовые клетки. Сначала пытались вводить просто сами стволовые клетки, но это не работало, они просто исчезали из организма. Эффективнее вводить не просто стволовые клетки, а то, что они выделяют, — так называемый секретом. Такие препараты дают защиту от клеточной гибели и улучшают метаболизм, дают стимул для пролиферации ткани.
При нарушении баланса «гибель-регенерация» происходит, например, фиброз. Фибробласты играют важную роль в нормальном восстановлении ткани после повреждения. Они продуцируют так называемый экстрацеллюлярный матрикс, что позволяет восстановить ткань. Но и сами фибробласты, и матрикс блокируют апоптоз, что приводит к фиброзу.
Также при нарушении баланса возникают опухолевые заболевания. Опухолевые клетки пользуются всеми теми же механизмами, что и нормальные ткани. Например, там, где опухоль растет, мало сосудов, клетки начинают погибать от недостатка питательных веществ или кислорода, возникает воспаление. Поэтому развитие опухоли похоже на незаживающую рану.
Итак, гибель клеток разнообразна, регулируется разными механизмами, постоянно взаимодействует с процессами пролиферации и регенерации. Существенно то, что она играет важную роль как в норме, так и при патологиях.


 Меню
Меню





 Все темы
Все темы




 0
0






