Иммунная система контролирует уровень глюкозы в крови
Ученые из Португалии вместе с коллабораторами нашли новые подтверждения влияния иммунной и нервной систем на регуляцию гомеостаза глюкозы. При голодании количество врожденных лимфоидных клеток типа ILC2 в поджелудочной железе увеличивалось, что способствовало выработке глюкагона и повышало уровень глюкозы в крови. ILC2 мигрировали из кишечника в поджелудочную железу после вызванной голодом активации катехоламинергических нейронов ЖКТ.
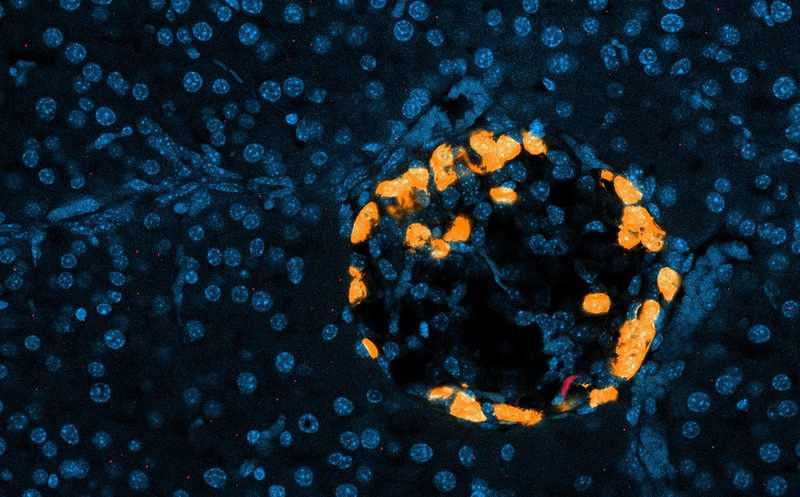
Во время голодания или физических упражнений иммунные клетки (красные) мигрируют в поджелудочную железу и стимулируют клетки, вырабатывающие глюкагон (оранжевые), для регулирования уровня сахара в крови; ядра клеток показаны синим цветом.
Credit:
Immunophysiology Lab, Champalimaud Foundation | Пресс-релиз
Современные исследования подтверждают, что иммунные клетки не только борются с патогенами, но и регулируют метаболизм. Например, Т-лимфоциты адаптивного иммунитета регулируют поглощение экзогенной глюкозы и расход энергии. Лимфоидные клетки врожденного иммунитета (ILC) модулируют метаболический гомеостаз в условиях воспаления. А нейроиммунные взаимодействия играют ключевую защитную роль при инфекциях слизистых, вызванных паразитами и бактериями, а также контролируют физиологию жировой ткани и развитие ожирения. Была выдвинута гипотеза, что нервная и иммунная системы могут взаимодействовать для управления энергетическими уровнями организма.
Ученые из Португалии вместе с коллабораторами показали в экспериментах на мышах, что клетки ILC участвуют в поддержании нормального уровня глюкозы и секреции глюкагона, подтверждая гипотезу о роли иммунной системы в регуляции энергетического обмена. Для проверки влияния иммунитета на гомеостаз глюкозы авторы сравнили уровень глюкозы натощак у мышей, лишенных различных иммунных клеток. Они показали, что мыши с дефицитом лимфоцитов и ILC имели более низкий уровень глюкозы натощак, чем мыши только с дефицитом лимфоцитов. Дополнительные эксперименты показали, что снижение уровня глюкозы было связано с нарушением эндокринной функции поджелудочной железы, а введение экзогенного глюкагона возвращало уровни глюкозы к нормальным значениям.
Учитывая возможную связь ILC с выработкой глюкагона поджелудочной железой, ученые исследовали влияние голодания на ILC, находящиеся в поджелудочной железе. У голодающих животных повышалось число ILC2, что указывает на то, что эти клетки могут модулировать выработку глюкагона. Трансплантация ILC2 мышам с отсутствием этих клеток восстанавливала уровни глюкагона и глюкозы в крови. Более того, добавление ILC2 поджелудочной железы в культуры альфа-клеток индуцировало высвобождение глюкагона за счет цитокинов IL-5 и IL-13.
Аналогично, было показано, что ILC2 действительно обнаруживаются in vivo в альфа-клетках островков Лангергнаса, а при голодании их количество заметно увеличивается. Ученые отследили судьбу ILC2 и обнаружили, что голодание индуцировало миграцию ILC2 из кишечника в поджелудочную железу. Таким образом, ILC2 регулируют гомеостаз глюкозы и уровень глюконеогенеза, увеличивая уровень глюкагона.
Ученые предположили, что сигналы от нейронов кишечника могут контролировать миграцию ILC2 в поджелудочную железу после голодания. Они обнаружили, что активация нейронов, связанных с кишечником, действительно увеличивает количество ILC2 в поджелудочной железе и повышает уровень глюкагона. В частности, речь идет о катехоламинергических нейронах. Ученые также обнаружили, что адренергический бета-2 рецептор (Adrb2), находящийся на ILC2, необходим для их миграции в поджелудочную железу.
Данное исследование подтверждает гипотезу о взаимодействии нервной и иммунной систем для регуляции уровня глюкозы в крови. Клетки врожденного иммунитета ILC2 способны при голодании мигрировать из кишечника в островки Лангерганса поджелудочной железы, где они стимулируют выработку глюкагона альфа-клетками, повышая уровень глюкозы в крови. Эти результаты могут быть использованы для разработки новых терапевтических подходов для лечения эндокринных заболеваний.
Найден новый путь, регулирующий энергетический баланс и потребление пищи у млекопитающих
Источник:
Marko Šestan, et al., Neuronal-ILC2 interactions regulate pancreatic glucagon and glucose homeostasis. // Science, 387,eadi3624(2025). DOI: 10.1126/science.adi3624


 Меню
Меню





 Все темы
Все темы




 0
0







