Ингибирование метаболизма плотоядных бактерий останавливает разрушение тканей
Толерантность к заболеванию — ответ организма на инфекцию, при которой он не борется с патогеном напрямую, а минимизирует наносимый ущерб и поддерживает нормальное функционирование, несмотря на присутствие возбудителя. Исследование ученых из США и Китая показало, что возбудитель некротизирующего фасциита, патогенная бактерия Streptococcus pyogenes, умеет вмешиваться в этот процесс, манипулируя иммунитетом хозяина. Воздействие на метаболические пути, используемые бактерией для подавления иммунной реакции, позволило контролировать поражение тканей у модельных мышей.
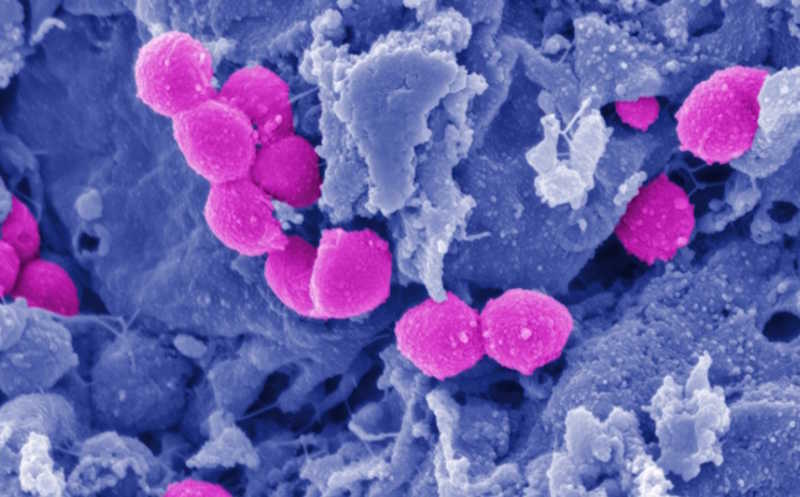
Сканирующая электронная микроскопия Streptococcus pyogenes в тканях.
Credit:
Wei Xu, Ph.D. assistant professor of biomedical sciences at the Marshall University Joan C. Edwards School of Medicine |
пресс-релиз
Толерантность к заболеванию — это стратегия защиты организма, при которой он не борется с патогеном напрямую, а минимизирует ущерб, наносимый инфекцией, и поддерживает нормальное функционирование, несмотря на присутствие возбудителя. «Плотоядная» бактерия Streptococcus pyogenes является возбудителем различных воспалительных заболеваний, в том числе некротизирующего фасциита — инфекции, поражающей фасции и подкожную жировую клетчатку. Статья, опубликованная в Nature Communications, посвящена взаимодействию между патогеном и иммунной системой — ее авторы обнаружили, что отдельные метаболические пути стрептококка модулируют иммунитет хозяина.
Метаболизм S. pyogenes основан на восстановлении пирувата до лактата. Как правило, эта реакция катализируется ферментом лактатдегидрогеназой (ЛДГ), однако у стрептококков есть альтернативные метаболические пути. Первый возможен исключительно в анаэробных условиях при участии фермента пируват-формиат-лиазы (ПФЛ), а второй — в аэробных условиях под действием ферментного комплекса пируватдегидрогеназы (ПДГ). При этом выделяются такие метаболиты как формиат, ацетат и лактат, обладающие подтвержденными иммуннорегуляторными свойствами и повышающие вирулентность бактерий. Предыдущие эксперименты показали, что повышенная экспрессия факторов вирулентности усиливает рост колонии, однако не коррелирует напрямую со степенью повреждения тканей. Поэтому исследователи решили подробнее изучить связь между метаболизмом патогена и прогрессированием инфекции. Классический ЛДГ-путь, как выяснилось, минимально влиял на вирулентность, в то время как ПФЛ-путь оказался ключевым для роста бактерий в тканях. Путь ПДГ, напротив, не имел значения для роста колонии, но влиял на тяжесть поражения тканей.
Сначала ученые определили роль ПДГ в формировании язв. Они заражали мышей двумя штаммами стрептококков: диким типом (WT) или штаммом с инактивированным ПДГ (ΔPdh), и наблюдали за динамикой бактериальных подкожных язв. Повреждения тканей при инфекции диким типом были обширнее, а сами бактерии медленнее выводились из тканей, что указывает на уникальную роль ПДГ в модулировании воспаления.
Затем авторы провели секвенирование РНК единичных клеток, чтобы проанализировать влияние ПДГ-пути стрептококка на клетки иммунной системы. В ΔPdh пробах наблюдалось большее количество макрофагов и нейтрофилов, а также снижение интерферонового и цитокинового сигналинга в B- и Т-лимфоцитах, соответственно. Используя флуоресцентную микроскопию, исследователи охарактеризовали пространственную динамику колонии бактерий в очаге воспаления. Спустя 3 дня после инфицирования стрептококк дикого типа оставался во внеклеточном пространстве, в то время как ΔPdh были локализованы преимущественно внутри макрофагов или нейтрофилов.
В опыте на мышах с нокаутом гена противовоспалительного интерлейкина 10 (IL-10) ученые установили, что углеродный обмен по ПДГ-пути способствует репрессии противовоспалительного ответа, при этом не изменяя активность прововоспалительного TNFα. Таким образом, ПДГ-путь замедляет заживление раны и усугубляет воспаление.
Дальнейшие эксперименты показали, что ПДГ регулирует соотношение короткоцепочечных карбоновых кислот, таких как ацетат и формиат, в клетках S. pyogenes. Это влияет на уровень ацетил-КоА в макрофагах и подавляет продукцию IL-10. Штамм ΔPdh вырабатывает меньше ацетата и формиата, что приводит к снижению уровня ацетил-КоА и ослаблению ацетилирования белков, включая гистоны. Добавление ацетата и формиата или ингибиторов гистондезацетилаз восстанавливало ацетилирование и подавляло продукцию IL-10. Ингибитор ПДГ H8 повышал уровень IL-10 в крови инфицированных мышей, тем самым замедляя рост S. pyogenes и сокращая повреждение тканей.
Это открытие показывает, что Streptococcus pyogenes использует пируватдегидрогиназу для модулирования метаболизма хозяина и подавления противовоспалительного ответа через регуляцию IL-10. Ингибирование ПДГ представляется перспективным для терапии, направленной не на уничтожение патогенов, а на снижение вреда от инфекции путем вмешательства в бактериальный метаболизм.
Синтетические антибиотики лечат смертельные «плотоядные» инфекции
Источник
Xu, W. et al. Reprogramming aerobic metabolism mitigates Streptococcus pyogenes tissue damage in a mouse necrotizing skin infection model // Nat Commun 16, 2559, published online 15 March 2025. DOI: 10.1038/s41467-025-57348-x


 Меню
Меню





 Все темы
Все темы




 0
0