Интервальное голодание снижает тяжесть протекания болезни Альцгеймера у мышей
Американские ученые показали, что интервальное голодание с шестичасовым окном для приема пищи значительно купирует некоторые симптомы болезни Альцгеймера у мышиной модели. Так, оно повышает качество сна и снижает поведенческие аномалии. Контроль времени питания также влияет на экспрессию генов, уменьшает размер и количество амилоидных бляшек в мозге и скорость их образования. Авторы считают целесообразным проведение клинических испытаний.
Credit:
UC San Diego Health Sciences | Пресс-релиз
Кроме накопления бета-амилоида и фосфорилированного тау-белка, болезнь Альцгеймера характеризуется также нарушением циркадных ритмов — уменьшением продолжительности сна и его фрагментированием, снижением активности во время бодрствования и усилением когнитивных симптомов к вечеру (так называемый синдром заходящего солнца). Ряд работ показал, что циркадные нарушения проявляются уже на ранних этапах заболевания и способствуют его развитию. В новой статье американские ученые показали на мышиной модели, что интервальное голодание (ограничение времени доступности пищи) восстанавливает нарушенные циркадные ритмы, исправляет ассоциированные с болезнью Альцгеймера изменения в экспрессии генов и даже уменьшает размер амилоидных бляшек в мозге.
Авторы использовали трансгенных (TG) мышей линии APP23, демонстрирующих широкий спектр признаков болезни Альцгеймера. Ученые подтвердили, что у этих животных нарушены циркадные ритмы, а экспрессия большого количества генов гиппокампа (n=258) изменена в сравнении со здоровыми мышами. У TG-мышей также наблюдались изменения в циркадных ритмах экспрессии ряда генов, включая как центральные циркадные гены (Dbp, Nr1d2, Per3 и Arntl), так и регулируемые ими гены.
В рамках эксперимента вводили ограничение кормления по времени (time-restricted feeding, TRF) — корм мышам выдавался в течение шестичасового окна в середине активного периода. Контрольную группу кормили ad libitum (ALF; с постоянным доступом к еде). Примечательно, что общее количество потребляемого корма и вес тела у TRF-группы не отличался от ALF-группы. Это значит, что наблюдаемые в процессе эксперимента эффект не был связан с дефицитом калорий.
Спустя три месяца TRF у самок мышей наблюдалось увеличение общей продолжительности сна до нормального уровня. У самцов увеличения продолжительности сна не наблюдалось, они по-прежнему чаще бодрствовали во время неактивного периода. Все мыши лучше засыпали, у них были менее выражены поведенческие аномалии, такие как гиперактивность в активную фазу.
Анализ экспрессии генов в гиппокампе по специальной панели показал изменение в экспрессии 86 генов, связанных с болезнью Альцгеймера, и 100 генов, связанных с нейровоспалением, у TRF-мышей в сравнении с ALF-группой. Общий транскриптомный анализ выявил 415 генов с изменениями в уровне экспрессии. Авторы также наблюдали изменения в экспрессии генов в определенные часы — 30 генов в момент наиболее продолжительного голодания и 151 ген в период кормления. Это показывает, что эффект голодания сохраняется и во время приема пищи. Интересно, TRF слабо влияло непосредственно на центральные циркадные гены, таким образом, эффект проявлялся за счет прямого влияния на гены, подконтрольные циркадным генам.
Отдельно авторы отмечают изменения в экспрессии гена Bmi1 (также называемого Pcg4) — транскрипционного фактора, участвующего в устранении повреждений ДНК и ремоделировании хроматина. Bmi1 контролирует 25 генов, экспрессия которых нарушена у TG-мышей. Для некоторых из них TRF восстанавливало уровень экспрессии до нормальных значений.
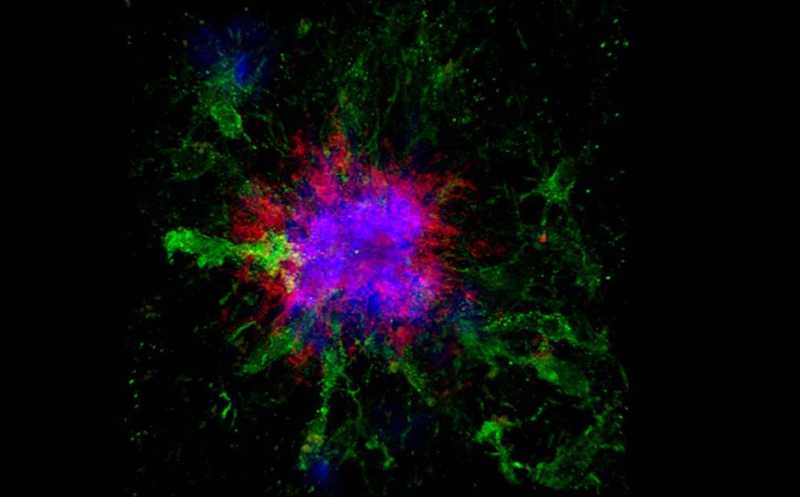
Иммунное окрашивание показало, что TRF умеренно, но значимо купировало потерю нейронов у TG-мышей. В TRF-группе значительно снижались размеры и число амилоидных бляшек в тканях мозга, а также замедлялось их образование. При этом эффект наблюдался уже на седьмой неделе интервального голодания. Схожие результаты были получены и на другой линии мышей, APP-KI, для которой характерна более быстрая прогрессия.
Наконец, APP-KI мыши из TRF-группы демонстрировали лучшие результаты в тестах на когнитивные способности и память. Восстановление когнитивных функций происходило почти до нормального уровня.
Таким образом, ограничение времени приема пищи оказывало значительный эффект на протекание болезни Альцгеймера у мышиной модели. Авторы рассчитывают в скором времени провести клинические испытания.
Развитию болезни Альцгеймера способствуют реактивные астроциты
Источник:
Whittaker D.S., et al., Circadian modulation by time-restricted feeding rescues brain pathology and improves memory in mouse models of Alzheimer’s disease // Cell Metabolism 35, 1–18 published October 3, 2023, DOI: 10.1016/j.cmet.2023.07.014


 Меню
Меню





 Все темы
Все темы




 0
0








