Искусственную почку с живыми клетками опробовали на свиньях
Ученые из США сконструировали искусственную почку, несущую человеческие клетки почечного эпителия. От иммунной системы реципиента клетки защищает силиконовая мембрана с нанопорами. Жизнеспособность и функция клеток после имплантации свиньям без иммуносупрессивной терапии сохранялись не менее семи дней.
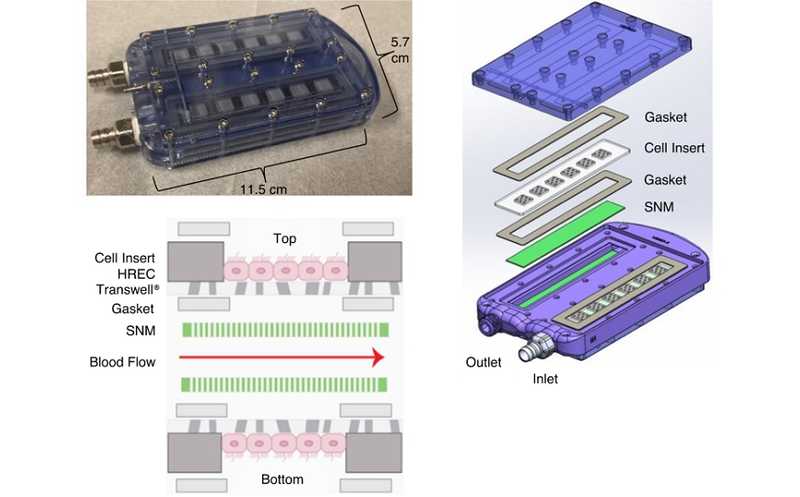
Устройство импланта. Объяснения в тексте
Credit:
Nat Com, 2023. DOI: 10.1038/s41467-023-39888-2 | CC BY 4.0
Более двух миллионов людей в мире страдают от терминальной почечной недостаточности. Хотя трансплантация почки позволяет достичь хороших результатов с пятилетней выживаемостью более 80%, у этого подхода есть серьезные ограничения — необходимость пожизненной иммуносупрессивной терапии и острый недостаток доноров. Разработка искусственного трансплантата призвана решить данные проблемы. В новой статье ученые из США представили результаты первичного тестирования искусственной почки с живыми клетками на свиньях.
Искусственная почка представляет собой U-образный канал, который подсоединяется к сосудам. Форма канала была специально рассчитана с использованием компьютерного моделирования потока для предотвращения образования тромбов (тромбогенность — серьезная проблема биомедицинских устройств). Сверху и снизу каждой из прямых секций находятся ячейки с человеческими эпителиальными клетками почек (HREC). Клетки отделены от кровяного потока тонкой (< 1 мкм) силиконовой мембраной с нанопорами, которая защищает клетки от иммунной системы реципиента, при этом позволяя отфильтровывать компоненты крови, необходимые для почечной функции. Клетки прилегают к мембране базальной стороной. Фильтрат из апикального резервуара (содержащий результат работы клеток) в данном исследовании не собирался. В будущем предполагается отводить его в мочевой пузырь реципиента либо через специальный порт во внешний резервуар для дальнейшего анализа.
Эффективность мембран была проверена in vitro. Для этого в специальный сосуд, разделенный на два отделения мембраной, помещали культуры HREC. Далее в одно из отделений вводили фактор некроза опухоли α (TNF-α). Через шесть часов концентрация TNF-α в обоих отделениях осталась практически неизменной. Клетки в отделении с TNF-α погибали, живыми оставалось менее половины, а в культуре, отделенной мембраной, — более 90%.
Для in vivo тестирования искусственные почки имплантировали пяти юкатанским (мексиканским лысым) свиньям. Животные получали антиагреганты (препараты, препятствующие агрегации тромбоцитов) — аспирин и клопидогрел. Почки были присоединены к сонной артерии и яремной вене или к подвздошным артерии и вене. У животных не наблюдалось ни побочных эффектов, связанных с операцией, ни признаков отторжения импланта. На второй день после имплантации у некоторых животных наблюдалось небольшое повышение уровня цитокинов в крови, однако к седьмому дню происходило возвращение к нормальным значениям.
Через три или семь дней после имплантации искусственную почку изымали для оценки. Ни на третий, ни на седьмой дни не наблюдалось признаков образования тромбов в кровеносном канале импланта. Доля живых клеток в системе превышала 90 % на обоих временных отсечках. В этом эксперименте изучалась прежде всего жизнеспособность клеток, а не их транспортная или метаболическая функция. Тем не менее количественный ПЦР-анализ показал значимое повышение экспрессии натрий-водородного антипортера 3, отвечающего за водно-солевой баланс, и 1-α-гидролазы, поддерживающей гомеостаз по кальцию, в сравнении с in vitro культурами. Не наблюдалось повышения экспрессии маркеров повреждения почек. Стоит отметить, что животные не получали иммуносупрессивную терапию после имплантации. Следующим шагом станут испытания в течение месяца, отмечается в пресс-релизе. Будет увеличено количество клеток в импланте, эксперименты проведут на большем количестве животных.
Таким образом, получены первые подтверждения эффективности искусственной почки, несущей человеческие клетки почечного эпителия, на животной модели и показана перспективность дальнейших исследований концепта.
Бета-клетки в упаковке из нановолокна дольше проживут в организме пациента с диабетом
Источник
Kim, E.J., et al. Feasibility of an implantable bioreactor for renal cell therapy using silicon nanopore membranes // Nature Communications, 14, 4890, published August 29, 2023. DOI: 10.1038/s41467-023-39888-2


 Меню
Меню





 Все темы
Все темы




 0
0







