Как изучать рецепторы, не зная их лигандов
Австрийские исследователи создали искусственные аналоги рецепторов, сопряженных с G-белком. Опыты in vitro показали, что синтетическая реплика точно имитирует естественный рецептор и вызывает аналогичные клеточные реакции при стимуляции синтетическим лигандом. Авторы говорят о том, что теперь можно изучать действие рецептора, не зная его эндогенных лигандов.
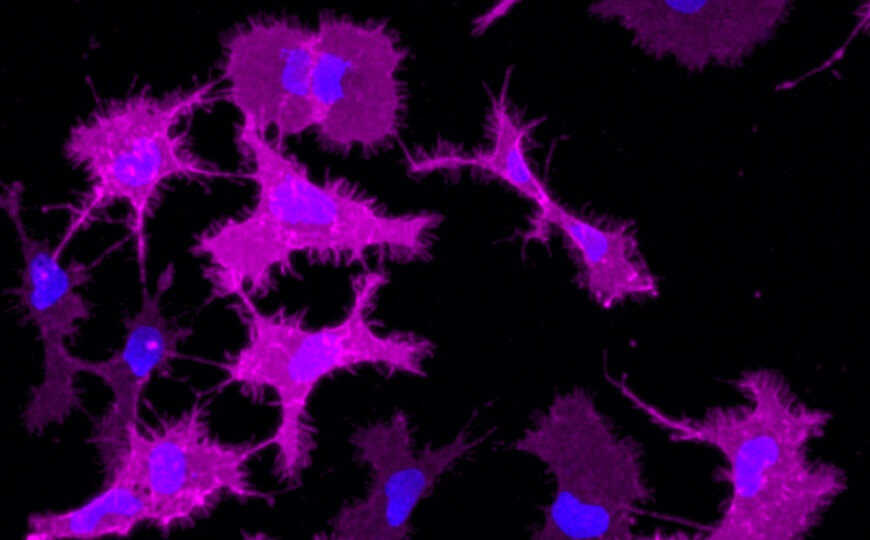
Микроглия с синтетическими рецепторами (розовые).
Credit:
© Rouven Schulz / ISTA |
Пресс-релиз
Рецепторы, сопряженные с G-белком, (G protein-coupled receptors, GPCR) — большая группа рецепторов, расположенных на клеточной мембране различных эукариотических клеток. GPCR выполняют функцию активаторов внутриклеточных сигнальных путей, вызывающих различные реакции: рост, миграцию, межклеточные коммуникации или изменение метаболизма. Внешние лиганды, которые активируют GPCR, варьируют в своих размерах от небольших молекул до сложных белков. Это могут быть гормоны, нейротрансмиттеры или феромоны.
Человеческий геном кодирует более 800 GPCR. При этом до сих пор не установлено, какие конкретно эндогенные лиганды активизируют существенную их часть. Кроме того, даже хорошо известные лиганды могут иметь низкую биодоступность или вызывать нежелательные побочные эффекты. Один и тот же рецептор, экспрессируясь на клетках разных тканей, вызывает разные эффекты, например, в иммунных клетках модулирует воспаление, а в бронхиальной ткани расслабляет мышечные клетки. Все это усложняет исследователям работу с семейством GPCR.
Команда ученых из Австрии разработала доступный и эффективный инструмент для всех, кто изучает GPCR. Они использовали хемогенетический метод DREADDs (Designer Receptors Exclusively Activated by Designer Drugs) для создания синтетических реплик рецепторных белков, которые не реагируют на обычные для них лиганды, но срабатывают в ответ на введение даже небольших концентраций определенных сигнальных веществ.
У каждого синтетического рецептора трансмембранные и наружные участки такие же, как у модифицированного человеческого мускаринового рецептора М3, который активируется клозапин-N-оксидом, а внутренние участки — как у изучаемого рецептора, и взаимодействуют с теми же молекулами внутри клетки, что и он. Если клетка экспрессирует такие химерные рецепторы, то клозапин-N-оксид должен вызывать такой же эффект, как эндогенный лиганд рецептора.
Авторы выбрали бета-2-адренергический рецептор (β2AR) из семейства адренергических рецепторов, играющий важную биологическую роль в организме человека. Его специфически связывают и активируют эндогенные лиганды — катехоламины, в частности адреналин.
Ученые синтезировали кодирующую последовательность DREADD-β2AR и встроили ее в вектор (плазмиду), который экспрессировали в клетках HEK293T. Через 24 часа с помощью иммуноокрашивания они показали, что DREADD-β2AR успешно встроился в клеточную мембрану.
Искусственная реплика β2AR избирательно активировалась только при взаимодействии с клозапин N-оксидом — синтетическим лигандом, широко используемым в биомедицинских исследованиях для активации дизайнерских рецепторов. Химерный DREADD-β2AR точно имитировал естественный рецептор и вызывал аналогичные клеточные реакции при стимуляции лигандом.
Особенно интересными оказались результаты, полученные на микроглии. Для анализа реакций этих клеток авторы тем же методом создали еще два дизайнерских рецептора — DREADD-GPR65 и DREADD-GPR109A. Каждый их них экспрессировали в своей клеточной линии. GPR65 и GPR109A — рецепторы, которые в значительных количествах присутствуют в нормальной микроглии наряду с β2AR. В природе активация всех этих рецепторов вызывает воспалительную реакцию.
И действительно, искусственные рецепторы DREADD-β2AR, встроенные в клеточную мембрану микроглии, при добавлении лиганда активировали воспалительный процесс. При этом сам клозапин N-оксид не провоцировал воспалительную реакцию. Сверхэкспрессия синтетических рецепторов вызывала более сильный клеточный ответ по сравнению с эндогенными β2AR.
Сигнатуры клеточного ответа отличались в зависимости от того, какие реплики рецепторов были встроены в клеточные мембраны: DREADD-β2AR или DREADD-GPR65. Активация DREADD-GPR109A не имела никакого эффекта. Ученые интегрировали еще один схожий химерный рецептор — rM3Ds — в мембрану микроглии. Они показали, что клетки отвечают на его активацию не так, как на эндогенный β2AR, DREADD-β2AR и DREADD-GPR65. Например, отличается характер экспрессии TNF и IL1β, но схема активации IL6 остается той же. Исследователи подтвердили, что в целом DREADD-β2AR более точно имитировал эндогенный β2AR, чем rM3Ds.
Авторы работы говорят о том, что теперь у ученых есть возможность разобраться в деталях функционирования рецепторов большого семейства GPCR и понять тонкие различия между схожими рецепторами. Также можно изучать рецепторы, не зная их эндогенных лигандов. Важно, что искусственные рецепторы активируются только под воздействием специально для них предназначенных синтетических препаратов и, следовательно, легко контролируются.
Источник
Schulz R., et al. Chimeric GPCRs mimic distinct signaling pathways and modulate microglia responses // Nature Communications (2022), published online 15 August 2022. DOI: 10.1038/s41467-022-32390-1


 Меню
Меню





 Все темы
Все темы




 0
0








