Хроническую боль при раке ротовой полости вызывает активность кальциевого канала ORAI1
Злокачественные новообразования ротовой полости провоцируют возникновение хронических болей, которые со временем усиливаются. Оказалось, что важную роль в метастазировании и росте таких опухолей, а также развитии болевого синдрома, играет кальциевый канал ORAI1. Авторы статьи в Science Signaling назвали его перспективной мишенью для таргетной терапии рака ротовой полости.
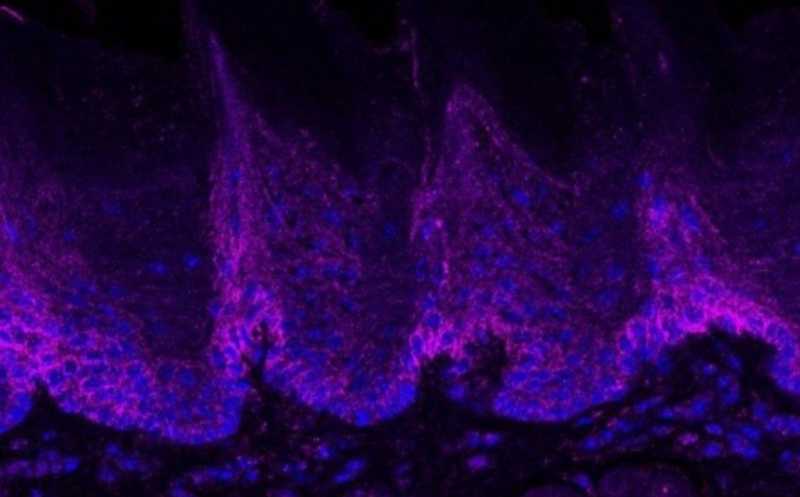
Злокачественные опухоли полости рта — это один из распространенных типов рака, который намного чаще диагностируют у мужчин. Клетки таких опухолей выделяют медиаторы для рецепторов боли (ноцицепторов), вызывающие сенсибилизацию первичных чувствительных нейронов. Из-за этого у пациентов с этим типом рака возникает постоянный болевой синдром, который усиливается по мере прогрессирования заболевания и сильно снижает качество жизни пациентов.
Уже известно, что малигнизация клеток сопровождается аномальной экспрессией генов, которые кодируют ионные каналы. При этом особое значение, в том числе для эпителиально-мезенхимального перехода, имеют изменения кальциевого гомеостаза. Эти изменения могут быть связаны с патологией активируемых кальцием кальциевых каналов (CRAC). В то же время их роль в развитии болевого синдрома или в прогрессии опухолей ротовой полости пока недостаточно изучена, поэтому на нее обратили внимание авторы статьи для Science Signaling, ученые из США.
Каналы CRAC опосредуют депо-зависимый вход кальция в клетку (store-operated calcium entry, SOCE). Этот процесс активируется в ответ на падение концентрации Ca2+ в эндоплазматическом ретикулуме, которое запускает олигомеризацию кальций-чувствительных белков на мембранах ЭПР — STIM1 и STIM2. Те далее перемещаются на периферию клетки, где связывают мембранные белки ORAI (ORAI1—ORAI3), запускающие устойчивый приток кальция в клетку.
Ранее уже было показано, что мутации в генах STIM1 и ORAI1 или их гиперэкспрессия ассоциированы с аденокарциномой, колоректальным и другими типами рака, что подчеркивает важность SOCE для онкогенеза. Именно этот процесс определяет приток кальция в раковые клетки. С помощью иммунофлуоресценции ученые установили, что ген ORAI1 активно экспрессируется в раковых клетках, полученных путем биопсии у пациентов со злокачественными новообразованиями рта.
Авторы сфокусировались на участии CRAC в трансформации нормальных кератиноцитов ротового эпителия в клетки плоскоклеточной карциномы и в процессах ноцицепции. Они оценили динамика SOCE в линии клеток рака ротовой полости человека и мыши, а также человеческих диспластических кератиноцитов.
Результаты секвенирования РНК указали, что ORAI1 регулирует активность многих генов, кодирующих маркеры рака ротовой полости (таких как металлопротеиназы MMP — для них показана связь в том числе с патологиями восприятия боли, например, нейропатиями) и модуляторы ноцицепции.
Исследователи подтвердили, что SOCE регулирует вход ионов кальция в раковые клетки человека и что этот процесс связан с усилением экспрессии MMP1 и генов других MMP. Это ж явление оказалось характерно для тканей с дисплазией. При этом блокирование ORAI1 предотвращало активацию экспрессии MMP и генов, кодирующих модуляторы ноцицепции при SOCE.
Авторы работы также изучили роль SOCE в опытах in vivo. Они вводили иммунодефицитным мышам клетки рака ротовой полости. Оказалось, что клетки, в которых с помощью малых шпилечных РНК был проведен нокдаун ORAI1, намного медленнее формировали опухоль у модельных животных, чем контрольные клетки без нокдауна. Кроме того, при нокдауне ORAI1 у мышей заметно снижался уровень аллодинии, индуцируемой опухолью.
Кроме того, нейроны тройничного нерва в присутствии опухолевых клеток, нокаутных по ORAI1, продемонстрировали меньшую возбудимость, чем в контрольных условиях. В присутствии металлопротеиназы MMP1 наблюдалась обратная картина — ее стимуляция сделала нейроны более возбудимыми.
Исследователи заключают, что депо-зависимый вход кальция в клетки может стать перспективной мишенью для лечения злокачественных опухолей ротовой полости и связанного с ними болевого синдрома.
Патогены полости рта повышают агрессивность оральных опухолей
Источник
Ga-Yeon Son et al. The Ca2+ channel ORAI1 is a regulator of oral cancer growth and nociceptive pain // Sci Signal (2023). DOI: 10.1126/scisignal.adf9535


 Меню
Меню





 Все темы
Все темы




 0
0








