Корейские ученые улучшили редактор оснований для митохондриальной ДНК
Редактор цитозина DdCBEs, предназначенный для модификации мтДНК, создан на основе бактериального токсина DddAtox. Токсин изначально разделен на две половины, что делает его безопасным для клетки, но спонтанное связывание половин приводит к нецелевой активности. Ученые из Южной Кореи повысили специфичность DdCBEs, заменив аминокислоты на границе связывания половин и предотвратив спонтанную сборку токсина.
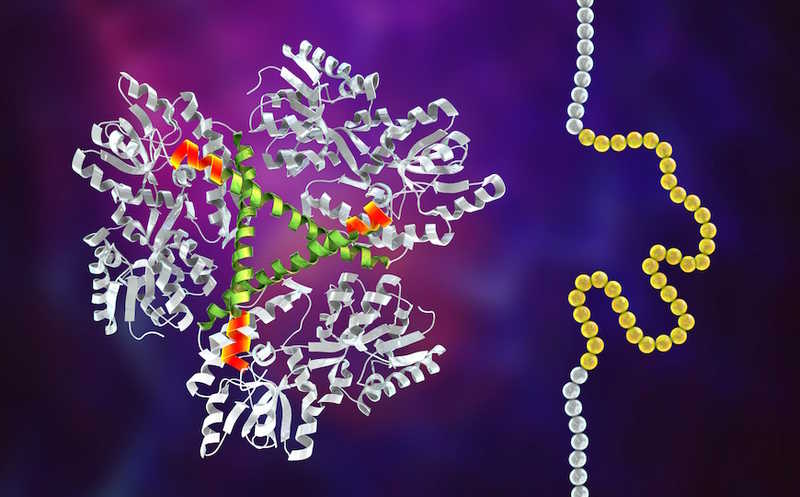
В 2020 году исследователи из Института Бродов с коллабораторами разработали систему для редактирования оснований в митохондриальной ДНК. Система, получившая название DdCBEs, заменяет C на T в контексте TC-мотива без разрыва цепи ДНК. Ее главный компонент — бактериальный токсин DddAtox, обладающий дезаминазной активностью. Чтобы избежать токсичности системы для клетки, ученые разделили DddAtox на две нетоксичные половины и к каждой присоединили домен TALE, который можно запрограммировать на распознавание определенной нуклеотидной последовательности. К N-концу химерной молекулы TALE-DddA присоединили ингибитор урацилгликозилазы (UGI), который дополнительно увеличивает эффективность редактирования. Когда последовательность-мишень распознается доменами TALE, половины DddA взаимодействуют друг с другом и образуют функциональную цитидиндезаминазу.
Недавно было показано, что DdCBEs вносит нецелевые мутации в геномы человеческих и мышиных митохондрий и в хлоропластные геномы растительных клеток. Ученые из Южной Кореи предположили, что точность системы снижают два фактора: неспецифические взаимодействия TALE-ДНК и спонтанная сборка DddAtox, не зависящая от активности TALE. Первый фактор определяется внешними причинами, например, выбором TALE-белка и мишени. Второй фактор представляет собой более общую проблему, поэтому ученые сосредоточились на нем. Они оптимизировали DdCBEs таким образом, чтобы предотвратить спонтанную сборку DddAtox.
На первом этапе команда с помощью специальной компьютерной программы определила аминокислоты двух половин DddAtox, взаимодействующие между собой при сборке токсина. Затем ученые создали серию мутантных половин DddAtox, в которых каждая из этих аминокислот была заменена на аланин с химически инертной боковой цепью. Мутантные половины токсина комбинировали с половиной дикого типа и проверяли работу получившихся редакторов цитозина на клетках. Варианты, показавшие наибольшую эффективность, протестировали в следующих раундах эксперимента: DdCBEs закодировали на плазмиде, трансфицировали человеческие клетки и проанализировали изменения в митохондриальной ДНК с помощью высокопроизводительного секвенирования. Митохондриальную ДНК необработанных редактором клеток также проанализировали, чтобы определить и учесть в дальнейшем природные однонуклеотидные вариации. При анализе эффективности редакторов оценивались их активность и количество нецелевых мутаций в мтДНК.
Самые точные системы получили название HiFi-DdCBEs. Их целевая активность была сопоставима с таковой для DdCBEs дикого типа, а нецелевая была значительно ниже: в зависимости от мишени исходные DdCBEs вносил от десятков до сотен нежелательных мутаций, HiFi-DdCBEs же — единицы и десятки, а в некоторых случаях не было выявлено ни одного нецелевого события. Авторы отмечают, что из созданного ими набора HiFi-DdCBEs можно выбрать наиболее подходящие для конкретных исследований. Так, если специфичность важнее активности, лучше подойдет вариант с мутацией T1391A в одной из половин DddAtox, а если предпочтительнее высокая активность, стоит использовать вариант K1389A.
По мнению авторов, в перспективе HiFi-DdCBEs будут использоваться для создания клеточных линий и животных, моделирующих заболевания.
Ранее эта же команда разработала платформу TALED для редактирования аденина в мтДНК.
Источник
Seonghyun Lee, et al. Precision mitochondrial DNA editing with high-fidelity DddA-derived base editors. // Nature Biotechnology, Published: 13 October 2022; DOI: 10.1038/s41587-022-01486-w


 Меню
Меню





 Все темы
Все темы




 0
0