Малая молекула повышает эффективность налоксона при передозировках опиоидов
Для спасения людей при передозировке опиоидных анальгетиков используют налоксон, но часто требуется несколько доз препарата, а в случае некоторых синтетических опиоидов, например, фентанила, его эффективность снижена. Ученые из США под руководством нобелевского лауреата Брайана Кобилки разработали модулятор μ-опиоидных рецепторов, который действует кооперативно с налоксоном, позволяя понизить его дозировку и уменьшить побочные эффекты.
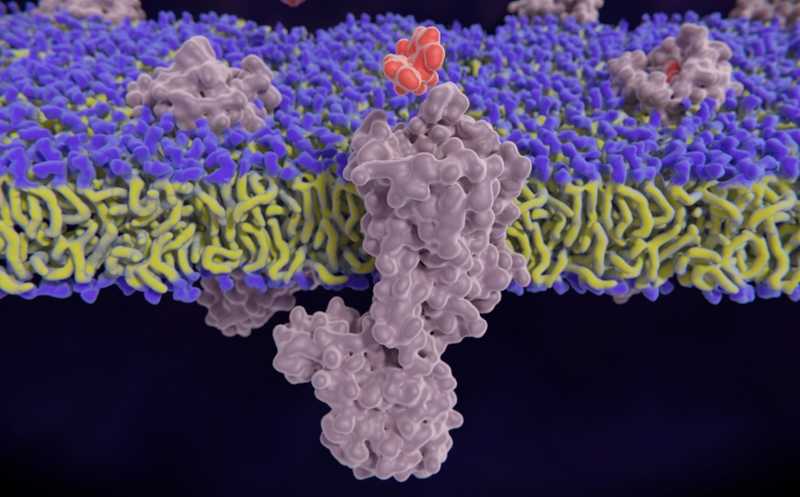
Мю-опиоидный рецептор и молекула морфина
Credit:
123rf.com
В последние годы в США развивается опиоидный кризис, связанный с неконтролируемым употреблением опиоидных анальгетиков, которые вызывают привыкание. В 2017 году опиоидная эпидемия даже была признана критической проблемой государства. Одним из распространенных опиоидных анальгетиков является фентанил — синтетический опиоид, действие которого в 100 раз сильнее, чем у морфина. Побочный эффект его применения — дыхательная недостаточность, которая становится смертельно опасной при передозировке. Получить ее достаточно легко: летальная доза фентанила для человека — 2 мг.
При передозировках применяется налоксон — антагонист опиоидных рецепторов. Он обладает высокой эффективностью, однако его время полувыведения из организма — всего 3–-60 минут. Из-за этого часто требуется вводить несколько доз налоксона, чтобы полностью нивелировать действие опиоидов. Кроме того, налоксон менее эффективен при передозировках фентанила и его аналогов, а также в случаях, когда помимо опиоидов человек употреблял алкоголь или другие наркотические вещества. Группа американских ученых под руководством Брайана Кобилки — лауреата Нобелевской премии по химии за исследование рецепторов, сопряженных с G-белком, — решила найти соединение, которое повысит эффективность налоксона. Они искали негативный аллостерический модулятор μ-опиоидных рецепторов. Такое вещество способно связываться с рецептором в аллостерическом центре и подавлять его активность, когда он взаимодействует со своим антагонистом.
Исследователи провели скрининг ДНК-кодированной химической библиотеки (DEL, DECL), включающей 4,4 млрд малых молекул, к каждой из которых присоединен свой ДНК-штрихкод для облегчения идентификации. Они искали такую молекулу, которая могла бы взаимодействовать с μ-опиоидными рецепторами, уже связанными с налоксоном.
В результате скрининга ученые обнаружили соединение, которое обозначили номером 368, и проверили его биохимические характеристики в in vitro и клеточных тестах. В комбинации с налоксоном соединение 368 подавляло действие морфина, фентанила и мет-энкефалина (эндогенный опиоид) на μ-опиоидные рецепторы, усиливая эффект налоксона в 7,6 раза. При этом само по себе это соединение в отсутствие налоксона не было способно ингибировать агонисты.
С помощью криоэлектронной микроскопии исследователи получили структуру μ-опиоидного рецептора в комплексе с налоксоном и соединением 368. Они показали, что оно напрямую контактирует с налоксоном и связывается с внеклеточным участком рецептора в аллостерическом кармане. Также оно стабилизирует неактивную конформацию внеклеточных фрагментов второй и седьмой трансмембранных спиралей рецептора.
Ученые проверили эффективность комбинации in vivo — на мышах. При внутривенном введении соединение 368 достигало мозга (25% от максимальной концентрации в плазме при введении в дозе 10 мг/кг), но время его полувыведения из организма оказалось относительно небольшим — 0,51 ч. Когда мышам вводили морфин, низкая доза налоксона — 0,1 мг/кг подкожно при обычно использующейся дозе 1–10 мг/кг — была недостаточной для того, чтобы подавить действие опиоида. Из-за действия морфина у мышей развивалась гиперлокомоция и угнетение дыхания, и налоксон только немного восстанавливал дыхательную функцию. Соединение 368 само по себе не оказывало никакого воздействия. Однако комбинация этого соединения и низкой дозы налоксона успешно подавляла действие морфина, восстанавливая дыхание и убирая гиперлокомоцию. Соединение 368 в дозе 100 мг/кг также нейтрализовало действие фентанила (0,1 мг/кг) в присутствии налоксона вне зависимости от его дозировки (0,3, 0,5 или 1 мг/кг).
Исследователи задались вопросом, может ли введение соединения 368 с налоксоном ослаблять симптомы синдрома отмены, наступление которого ускоряется из-за введения налоксона. Через пять дней приема морфина и последующего введения налоксона у мышей развивалась диарея, они стучали зубами. Эти и другие проявления синдрома отмены были менее выраженными при использовании низкой дозы налоксона. Если же до налоксона вводили соединение 368, то у животных реже встречались проблемы со стулом, хотя другие проявления симптома отмены подавить не удалось.
Миелинизация нейронов способствует формированию опиоидной зависимости
Источник
O'Brien, E. et al. A µ-opioid receptor modulator that works cooperatively with naloxone // Nature (2024). DOI: 10.1038/s41586-024-07587-7


 Меню
Меню





 Все темы
Все темы




 0
0








