Маленькие нуклеазы огромных фагов — новый инструмент для редактирования геномов
Компания Mammoth Biosciences заключила эксклюзивное лицензионное соглашение с Калифорнийским университетом в Беркли на исследования, разработку и коммерциализацию нуклеаз Casɸ — нового семейства белков CRISPR-Cas. Эти нуклеазы, обнаруженные в бактериофагах, возможно, будет использованы для терапевтического редактирования, в том числе in vivo — в живом организме.
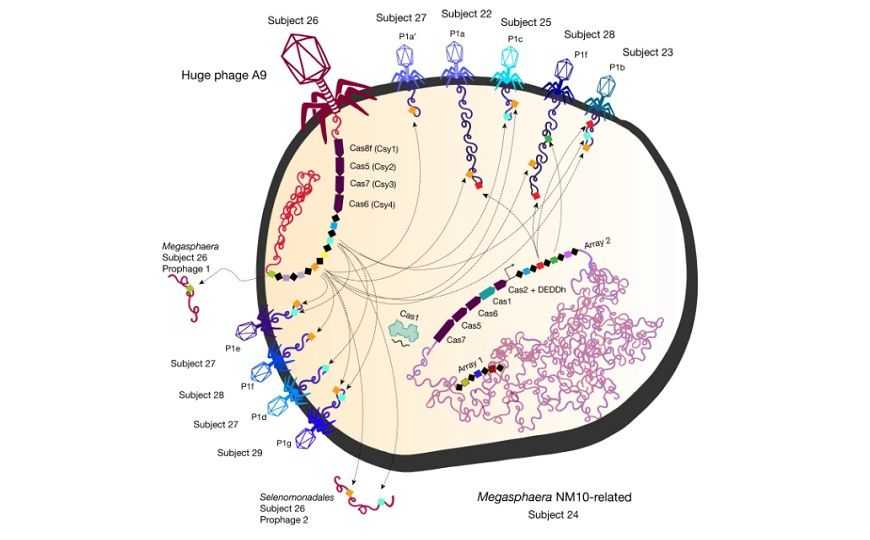
Бактериально-фаговые и фаг-фаговые взаимодействия CRISPR-систем во время одновременной инфекции одной клетки разными фагами. Стрелками показано нацеливание CRISPR-Cas на профаговые и фаговые геномы. Огромный фаг — вверху слева
Credit:
Nature, 2020, 578, 425–431; DOI: https://www.nature.com/articles/s41586-020-2007-4 | CC 4.0
Белки-нуклеазы CasΦ (греческая буква «фи» в молекулярной биологии традиционно обозначает бактериофагов) обнаружили исследователи под руководством соучредителя Mammoth и пионера CRISPR Дженнифер Дудны и Джиллиан Бэнфилд из Калифорнийского университета в Беркли. В феврале Nature опубликовал их масштабное исследование геномов огромных фагов. (Huge phages — собирательное название, которое авторы предложили для фагов с геномами более 200 т.н.) Изучали, в частности, их CRISPR-Cas-системы, с помощью которых фаги воздействуют на трансляцию в клетке бактерии-хозяина, чтобы перенастроить биосинтез для собственной выгоды. Некоторые фаги также перепрофилируют собственную систему CRISPR-Cas бактериальной клетки для устранения фагов-конкурентов. В статье упоминается новая CRISPR-Cas-система, найденная у группы родственных фагов и включающая нуклеазу CasΦ (Cas12j). Это очень маленький белок, примерно вдвое меньше часто используемых нуклеаз Cas9 и Cas12 — размером около 70 килодальтон, длиной около 750 аминокислот.
Дудна, Банфилд и их коллеги описали CasΦ в статье, опубликованной в Science. Авторы исследовали три ортолога — CasΦ-1, CasΦ-2 и CasΦ-3 — и показали, что CasΦ используют один и тот же активный сайт и для процессинга РНК CRISPR (crRNA), и для разрезания чужеродной ДНК, на который ее нацеливает crRNA. Это очень экономный вариант, не требующий дополнительных «деталей» для редактирования участка-мишени в геноме. Компактность выгодна для доставки в клетку и позволяет воздействовать на более широкий диапазон геномных последовательностей, отмечают авторы. Они также подчеркнули, что эта сверхкомпактная система геномного редактирования активна in vitro и в клетках человека и растений.
Строго говоря, CasΦ не самые маленькие нуклеазы Cas — самыми маленькими на сегодняшний день остаются члены семейства Cas14 длиной 500–800 аминокислот, но они требуют дополнительных РНК-элементов, таких как tracrRNA.
Интересно, что семейство нуклеаз CasΦ, в отличие от многих других, обнаружено только в бактериофагах, но не в бактериях или археях. Причем это бактериофаги окружающей среды (они найдены в мелких водоемах, влажной лесной подстилке), а не вирусы патогенных или кишечных бактерий человека, поэтому маловероятно, чтобы на CasΦ был иммунный ответ, в отличие, например, от Cas9. С другой стороны, его способность разрезать одноцепочечную ДНК в транс-конфигурации интересна для диагностических инструментов, подобных DETECTR или SHERLOCK.
Получив лицензию на белки CasΦ, Mammoth стремится изучить возможности CasΦ для практического использования, как в диагностических, так и в терапевтических целях, прежде всего — в системах редактирования in vivo. Исследователи компании детально охарактеризовали новые ферменты и сейчас занимаются поиском других ортологов Cas и других фаговых нуклеаз. «Одна из сильных сторон Mammoth заключается в том, что у нас есть группа по разработке белков, которую мы использовали для разработки Cas14, и мы очень рады, что эта группа также продолжит разработку CasΦ, — сказал соучредитель и генеральный директор Mammoth Тревор Мартин. — Мы собираемся исследовать все семейство. Я думаю, оно может многое предложить».
Калифорнийский университет лицензировал компании нуклеазу Cas14 в марте 2019 года, вскоре после того, как фермент был обнаружен Дудной и ее командой. По словам Мартина, компактные CasΦ и Cas14, которые можно упаковать в различные системы доставки, вписываются в планы Mammoth по созданию способов эффективного и безопасного редактирования генома in vivo вместо ex vivo. Мартин отметил, что предстоит еще много работы, прежде чем новый ферменты будут готовы к использованию в клинике.
В настоящее время компания изучает возможности партнерства с фирмами, которые помогут в разработке приложений, использующих CasΦ, в терапии, диагностике, сельском хозяйстве или других областях.
Как говорит Басем Аль Шайеб, один из ведущих авторов статьи в Nature, их работа показала, как мало нам известно о биологии CRISPR. «Даже при всех наших знаниях о бактериях и вирусах мы почти не касаемся того, что там происходит,— сказал он. — Мы способны культивировать менее процента известных нам бактерий и небольшую часть вирусов, которые заражают этот один процент. Нам еще многое предстоит узнать о биологии вокруг нас и о том, что эти существа могут делать».
Источники
Basem Al-Shayeb, et al. // Clades of huge phages from across Earth’s ecosystems // Nature, 2020, 578, 425–431; DOI: 10.1038/s41586-020-2007-4
Patrick Pausch, et al. // CRISPR-CasΦ from huge phages is a hypercompact genome editor // Science, 2020: 369, 6501, 333-337, DOI: 10.1126/science.abb1400
Christie Rizk. // Mammoth Biosciences Eyes Multiple Applications for Newly Discovered UC Berkeley CRISPR Proteins. // Aug 12, 2020


 Меню
Меню





 Все темы
Все темы




 0
0