МД-2023: Фармакогенетика и фармакогеномика — настоящее и будущее
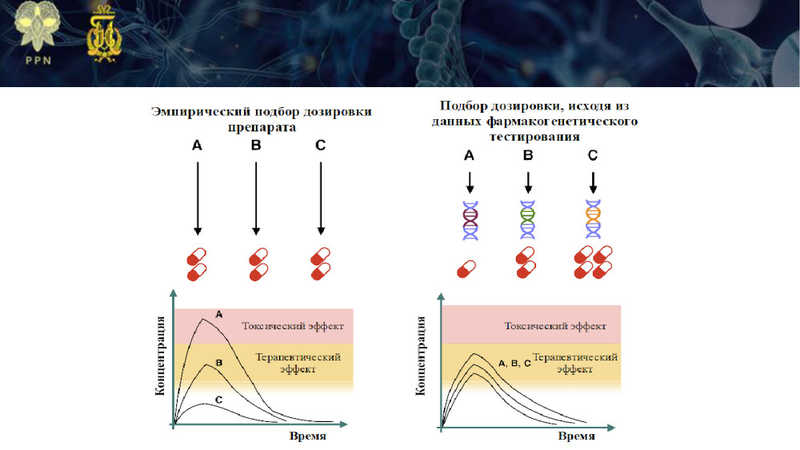
При подборе лекарственного средства важно оценивать как эффективность, так и безопасность лечения. То, как пациент ответит на терапию, зависит в том числе от его генетических особенностей — их позволяет учесть фармакогенетический подход. Как генетический тест поможет подобрать оптимальную дозировку препарата? Как учесть этнические особенности пациента при назначении препарата? Какие биомаркеры укажут на риск развития метаболических нарушений при приеме антипсихотиков? И, наконец, что необходимо для трансляции фармакогенетических исследований в клиническую практику?

Секцию открыл Дмитрий Сычев (ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России), д.м.н., академик РАН, который выступил с докладом о проблемах внедрения фармакогенетического тестирования в клиническую практику.
Летом правительство страны утвердило концепцию технологического развития на период до 2030 года, где генетические технологии обозначены как приоритетные. В России активно развиваются фармакогенетические тестирования по многим направлениям: психиатрия и неврология, кардиология, инфекционные болезни, педиатрия, офтальмология, боль и послеоперационное обезболивание, урология и так далее. В этой разработке задействованы более 30 кафедр Российской медицинской академии непрерывного профессионального образования (РМАНПО). Какие же шаги требуются для того, чтобы фармакогенетика внедрилась в реальную клиническую практику? Для этого необходимы взаимодействия в профессиональном сообществе, которые обеспечат внедрение доказательных алгоритмов персонализации на основе фармакогенетики в клинические рекомендации. Также важна работа с отечественными производителями, чтобы обеспечить разработку, регистрацию и выход на рынок дополнительных ПЦР тест-систем для проведения фармакогенетического тестирования. Наконец, необходимо создать консенсусный документ, который регламентировал бы эту сферу — начиная от установления терминологии и заканчивая тем, каким образом изучаются, разрабатываются, и клинически интерпретируются фармакогенетические тесты.
Тему фармакогенетически-информированной фармакометаболомики подняла Наталья Шнайдер (НМИЦ психиатрии и неврологии им. Бехтерева), рассказав о ней в контексте эпилептологии.
С точки зрения сроков проведения фармакогенетического тестирования в эпилептологии, как и в других направлениях медицинской науки, можно увидеть два основных подхода. Один из них — это прореактивное фармакогенетическое тестирование, то есть назначение фармакогенетического тестирования до развития лекарственно-индуцированных нежелательных реакций. Однако чаще поступают наоборот и назначают тестирование в случаях, когда пациент уже имеет достаточно большой анамнез.
Один из широко применяемых антиконвульсантов, которые также используют в психиатрии — вальпроевая кислота. Ее фармакогенетически информированное назначение несколько тяжелее, поскольку требует дополнительного этапа тестирования, однако на порядок повышает безопасность применения. Препарат может метаболизироваться в организме пациента с разной скоростью. Исходя из этого, пациентов можно ранжировать на четыре фенотипа: ультрабыстрых, быстрых, промежуточных и медленных метаболизаторов. Два последних фенотипа вызывают наибольший интерес с позиции безопасности терапии и метаболических расстройств, индуцированных вальпроатом. При достаточно медленном метаболизме повышен риск достичь токсического уровня вальпроевой кислоты в сыворотке крови, что может привести, например, к развитию нейротоксичности.
Также в контексте безопасности препаратов представляет интерес фармакометаболомика, которая занимается количественным анализом метаболитов препарата в биологических жидкостях пациента. На этой области основывается такой подход, как фармакометаболически-информированная фармакогеномика. Его суть состоит в анализе уровней метаболитов препарата, за которым может следовать фармакогенетическое тестирование в том случае, если эти показатели повышены. Этот подход требует крайне аккуратной работы с нестабильными метаболитами вальпроевой кислоты и зачастую оказывается неприменим в контексте стоящей перед эпилептологами задачи. В качестве альтернативы ему предложили фармакогенетически-информированную метаболомику — первым этапом здесь становится фармакогенетическое тестирование, а по его результатам уже проводится метаболомика, учитывающая, носителем какого аллеля риска является конкретный пациент.
Тему безопасности препаратов развила в докладе Регина Насырова, которая также представляла НМИЦ психиатрии и неврологии им. Бехтерева. Она рассказала о фармакогенетике в контексте антипсихотической терапии. Сейчас существует три поколения антипсихотиков, и все они вызывают те или иные нежелательные реакции. К наиболее назначаемым в РФ антипсихотикам сейчас относятся препараты второго поколения, и они эффективнее купируют негативную симптоматику, чем антипсихотики первого поколения, но вызывают метаболические нарушения, способные сокращать срок жизни пациента.
Согласно приведенным в докладе оценкам, на антипсихотиках первой генерации пациент живет в среднем на 10 лет меньше, чем не принимающие препаратов ровесники, а на антипсихотиках второй генерации — уже на 20, поскольку у него возникают метаболические нарушения, провоцирующие такие расстройства, как сахарный диабет, набор массы тела и так далее. Это подводит нас к необходимости фармакогенетических исследований в психиатрии, которые позволили бы выявить у пациентов маркеры, ассоциированные с высоким риском антипсихотик-индуцированных расстройств.
В рамках совместного исследования, проведенного Центральным НИИ Эпидемиологии и НМИЦ психиатрии и неврологии им. Бехтерева, изучили биомаркеры развития антипсихотик-индуцированных метаболических нарушений. Среди кандидатных маркеров оказались компоненты системы лептина, нейропептид Y и его рецептор. Результаты показали, что из 15 кандидатных локусов SNP два могут быть включены в клинические рекомендации и в тест-системы на территории РФ, и сейчас ведется работа над тем, чтобы включить их в клинические рекомендации.
Елена Зеленская (ФГБУН «Институт химической биологии и фундаментальной медицины СО РАН») представила исследование фармакогенетики тикагрелора в контексте этнических особенностей метаболизма. Тикагрелор и клопидогрель — антиагрегантные препараты, которые применяют в составе двойной антиагрегантной терапии у пациентов с острым коронарным синдромом. Существуют полиморфизмы, ассоциированные со снижением эффективности клопидогреля для пациента, и их носителям рекомендован тикагрелор, хотя варианты, влияющие на его метаболизм, изучены не до конца. Один из уже известных маркеров — SLCO1B1 (ген белка-переносчика, который транспортирует молекулы препарата в гепатоциты).
Ключевую роль в метаболизме клопидогреля играет цитохром CYP2C19. В нем известны полиморфные аллели, ассоциированые с риском осложнений, например, тромбозов или кровотечений. Этнические различия в носительстве таких аллелей важны для пациентов РФ, ведь это многонациональная страна, и частота встречаемости аллеля может различаться между популяциями. В исследовании приняли участие пациенты Регионального сосудистого центра Улан-Удэ. Задачей было оценить ассоциацию генотипа с клиническими исходами у бурятских пациентов, которые перенесли острый коронарный синдром. Генетический анализ включенных в исследование групп показал, что аллель SLCO1B1, ассоциированный с повышением тикагрелора в крови, чаще встречался у русских пациентов и реже у бурят. Также у бурятских пациентов значимо чаще встречался аллель CYP2C19*3, и достоверно реже — CYP2C19*17. Носительство CYP2C19*3 было ассоциировано с более частыми тромботическими осложнениями у русских пациентов, но не у бурятских. У последних при приеме клопидогреля чаще возобновлялась ангинозная боль, которая предположительно указывала на риск развития серьезных осложений, таких как инфаркт миокарда. Дальнейший анализ показал, что она была ассоциирована с факторами риска этого осложнения, такими как возраст, мужской пол, показатели глюкозы в крови и носительство уже упомянутых аллелей риска.
Фармакогенетические тестирования применяют не только в медицине, но и в спорте. Одно из разрешенных, хотя и контролируемых Всемирным антидопинговым агентством, соединений — это кофеин. Он часто используется в видах спорта, связанных с аэробной выносливостью. О фармакогенетических аспектах персонифицированного подхода к употреблению кофеина спортсменами и его исследовании рассказал Максим Амельянович (Институт генетики и цитологии НАН Беларуси ). Индивидуальную чувствительность к кофеину связывают в первую очередь с полиморфизмами генов, кодирующих цитохром P450 (CYP1A1, CYP1A2), рецептор ароматических углеводородов (AHR) и рецептор аденозина (A2AR). Они определяют, в частности, скорость метаболизма кофеина — так, в зависимости от генотипа по полиморфному варианту гена CYP1A1 она может отличаться до четырех раз.
Результаты исследования, проведенного на 104 спортсменах, указали на некоторые такие ассоциации. Участники прошли генотипирование и ряд физических тестов. Для двух полиморфных вариантов в генах CYP1A1 и CYP1A2 было продемонстрировано уменьшение времени реакции после нагрузки с кофеином в сравнении с исходным состоянием, а без кофеина такой разницы не наблюдалось.

Следующие три доклада были представлены сотрудниками ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
 Шохрух Абдуллаев
Шохрух АбдуллаевФото:
Денис Зыбин
Первый из них был посвящен перспективе фармакогентического тестирования для персонализации применения альфа-адреноблокаторов. Шохрух Абдуллаев рассказал, что эти препараты применяются для терапии доброкачественной гиперплазии предстательной железы (ДГПЖ) — широко распространенного заболевания. Один из популярных препаратов — тамсулозин — имеет достаточно высокие показатели эффективности и безопасности. Однако в метаболизме (препарат метаболизируется с участием CYP3A4/5 и CYP2D6) сохраняется высокая межиндивидуальная вариабельность, и треть пациентов сообщают о неэффективности лечения. Это ставит перед исследователями задачу проанализировать, как полиморфизмы CYP3A и CYP2D6 влияют на эффективность и безопасность тамсулозина у пациентов с ДГПЖ. Исследование было начато на небольшой выборке, которую в перспективе планируют расширить. Вклад CYP3A и CYP2D6 будут изучать, опираясь на корреляцию между носительством тех или иных полиморфизмов CYP3A и CYP2D6 и фармакокинетическими показателями, а также на уровни эндогенных метаболитов.
 Анастасия Асоскова
Анастасия АсосковаФото:
Денис Зыбин
Еще одно важное исследование, посвященное в первую очередь безопасности применения препарата, осветила Анастасия Асоскова. Ее доклад был посвящен фармакогенетике метотрексата у пациентов с псориазом. Метотрексат — лекарственное средство выбора для назначения пациентам с псориазом, однако он может вызывать серьезные нежелательные реакции. Из-за них 14–30% пациентов отменяют лечение этим препаратом. Уже было показано, что генетические особенности могут повышать риск развития токсичности метотрексата до 13 раз.
Дальнейшее исследование, о котором рассказала Анастасия, было посвящено разработке алгоритма прогнозирования безопасности метотрексата для больных среднетяжелыми и тяжелыми формами псориаза. С риском токсичности были ассоциированы полиморфизмы двух генов: ABCB1 и SLCO1B1, кодирующих белки-транспортеры. Минорный аллель Т по полиморфизму rs1045642 гена ABCB1 приводит к синтезу белка с пониженной активностью, и, как следствие, снижает выведение метотрексата гепатоцитами. В гене SLCO1B1, напротив, за токсичность отвечает «дикий» генотип по полиморфизму rs4149056: он обеспечивает активный захват молекул метотрексата гепатоцитами. В обоих случаях носительство аллеля риска усиливает токсическое действие метотрексата.
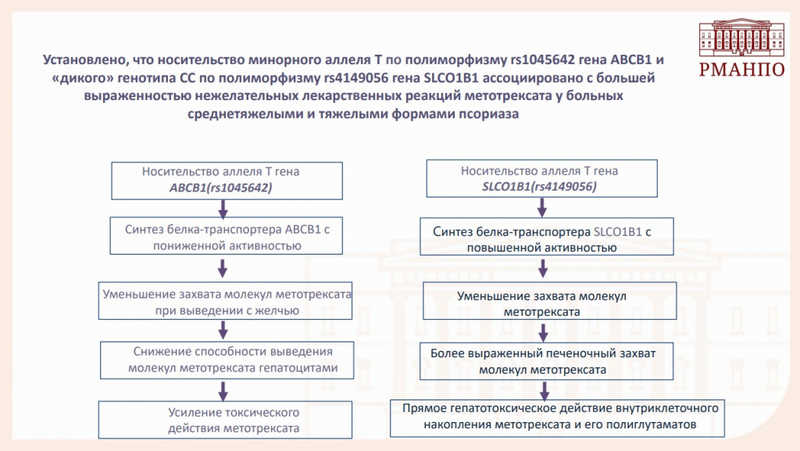
На основании этого предложен алгоритм прогнозирования безопасности терапии. Если в ходе фармакогенетического тестирования у пациента выявлен хотя бы один из упомянутых аллелей риска, то рекомендованными препаратами будут в первую очередь те, которые не относятся к группе метотрексата — потенциально такой подход позволит снизить риск токсичности.
Последним в секции выступил Ильяс Темирбулатов, который рассказал о фармакогенетических предпосылках развития гепатотоксичности ремдесивира у пациентов с COVID-19. Ремдесивир — противовирусный препарат широкого спектра. Это пролекарство преобразуется в активный метаболит под действием нескольких ферментов: карбоксилэстеразы 1 (CES1), CYP3A и катепсина А. Поскольку препарат нередко вызывает гепатотоксические эффекты (повышение печеночных трансаминаз — одна из самых частых нежелательных реакций), целью исследования стала оценка того, как полиморфизмы в генах CES1, CES2 и CYP3A влияют на гепатотоксичность ремдесивира у пациентов с COVID-19.
Риск подъема уровня аспартатаминотрансферазы был достоверно выше у носителей варианта GA гена CYP3A5*3 (rs776746). Также риску гепатотоксичности были подвержены носители полиморфных гомозиготных вариантов гена CES1 (rs2244614, rs8192950 и rs8192935) . Ильяс подчеркнул, что на фармакогенетическом исследовании, включающее генотипирование по этим полиморфизмам, может основываться прогнозирование безопасности терапии ремдесивиром при COVID-19.
Информация о докладчиках
Сычев Дмитрий Алексеевич, д.м.н., профессор, академик РАН; ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
Шнайдер Наталья Алексеевна, д.м.н., профессор; ФГБУ «Национальный медицинский исследовательский центр психиатрии и неврологии им. В.М. Бехтерева», г. Санкт-Петербург
Насырова Регина Фаритовна, д.м.н., ФГБУ «Национальный медицинский исследовательский центр психиатрии и неврологии им. В.М. Бехтерева», г. Санкт-Петербург
Зеленская Елена Михайловна, ФГБУН «Институт химической биологии и фундаментальной медицины СО РАН», г. Новосибирск; Республиканская клиническая больница, г. Улан-Удэ
Амельянович Максим Дмитриевич, Институт генетики и цитологии НАН Беларуси, г. Минск, Республика Беларусь
Абдуллаев Шохрух Пардабойевич, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
Асоскова Анастасия Валерьевна, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
Темибулатов Ильяс Ильдарович, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва


 Меню
Меню





 Все темы
Все темы




 0
0