МД-2023: Инфекции желудочно-кишечного тракта
Кишечные инфекции распространены повсеместно и могут быть вызваны разнообразными бактериальными и вирусными патогенами. Живут ли сальмонеллы в бельгийском шоколаде и вафлях? Так ли безобидна кишечная палочка? Какие иерсинии распространены в России? Откуда к нам пришел реассортантый ротавирус? Как обнаружить кишечные патогены или энтеровирус типа D68 и поможет ли в этом изотермическая амплификация? Эти и другие вопросы обсуждали на секции «Молекулярно-биологические методы в изучении инфекционной патологии желудочно-кишечного тракта».

Секцию открыли сотрудники Санкт-Петербургского НИИ эпидемиологии и микробиологии имени Пастера — Лидия Кафтырева, Мария Макарова и Екатерина Воскресенская. Они представили доклады о выявлении и изучении основных бактериальных патогенов, вызывающих кишечные инфекции.
Первая докладчица, д.м.н., профессор Лидия Кафтырева, рассказала слушателям о молекулярно-генетических технологиях в лабораторной диагностике сальмонеллезов. Она напомнила, что инфекционные заболевания, возбудителем которых являются бактерии рода Salmonella, характеризуются полиморфизмом клинического течения, преимущественно поражают ЖКТ с возможной генерализацией и различной степенью выраженности симптомов общей интоксикации и обезвоживания. Болеют и дети, и взрослые.
 Председатели Секции Лидия Кафтырева и Александр Подколзин
Председатели Секции Лидия Кафтырева и Александр Подколзин
Современная схема классификации Кауфмана-Уайта включает 2579 серовариантов сальмонеллы, а вид S. enterica подвид enterica (возбудители, инфицирующие людей) — 1531 серовариантов. Французские специалисты отмечают, что классическое серотипирование S. enterica может вводить в заблуждение и необходимо переходить на другие методы, которые бы позволили четко определять штаммы. Они предлагают использовать молекулярное серотипирование — определение серологического варианта на основе детекции генов, кодирующих синтез О и Н антигенов, определение сероваров на основе детекции сиквенс-типов и другие. Однако применять такие подходы в рутинной практике затруднительно, и они тоже могут приводить к ошибкам при проведении эпидемиологического расследования или микробиологического мониторинга.
Лидия Алексеевна рассказала о клонах микроорганизмов, способных к широкому распространению. Их называют «эпидемические клоны» (а еще — успешные клоны, клоны высокого риска, клоны пандемического распространения и т.д.). Клон высокого риска должен обладать такими признаками, как глобальное распространение, множественная устойчивость к антибиотикам, повышенная вирулентность, высокая выживаемость во внешней среде, способность вызывать тяжелые заболевания и накапливать детерминанты вирулентности и резистентности к антимикробным препаратам. Очень многие серовары сальмонелл соответствуют этим критериям. Возникновению и эволюции успешных клонов способствуют широкое применение антимикробных препаратов (АМП( в медицине, сельском хозяйстве, растениеводстве и других сферах.
Одним из первых примеров таких клонов — полирезистентные S.Typhimurium фаготипа 104. К 1990 году они стали серьезной проблемой во многих европейских странах. Заболевания у людей были связаны с употреблением цыплят, говядины, свинины, сосисок и паштетов.
Другим примером может быть S. Kentucky серогруппы С2, отдельные штаммы которой были выделены в России в 2015 и 2019 годах. Впервые они были обнаружены в Египте в 1989 году, приобрели резистентность к ампициллину, стрептомицину, гентамицину, тетрациклину и другим препаратам. В настоящее время S. Kentucky — результат клональной экспансии одной генетической линии сиквенс-типа 198, которая в 2000-х годах с мясом птицы распространилась в Африке, Центральной Азии, Индии, Европе и Канаде. Клон продолжает эволюционировать и сейчас, проявляет устойчивость уже к современным АМП: цефалоспоринам, карбапенемам, азитромицину, металлам и четвертичным аммонийным соединениям. В странах Евросоюза более 90 % штаммов этого серовара устойчивы к фторхинолонам.
Селекции ещё одного клона, S. Newport серогруппы C, способствовало разрешение использовать цефтриофур для крупного рогатого скота. Клон распространен в основном в США и устойчив к 7 из 9 классам антибиотиков. В Европе такие штаммы выделяли редко, однако во Франции в 2003 году была зафиксирована вспышка, связанная с употреблением конины из США.
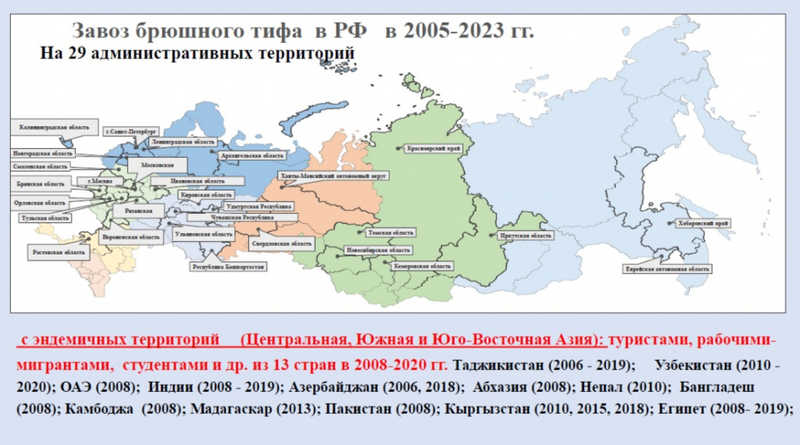
Далее Лидия Алексеевна рассказала про брюшной тиф. У нас в стране этого заболевания нет, но в период с 2005 до 2023 годы на 29 территорий России выявлены случаи его завоза рабочими-мигрантами, студентами и туристами из 13 стран (Таджикистан, Узбекистан, Индия, Египет, Камбоджа и др.). По результатам молекулярно-генетического типирования оказалось, что 76% таких завезенных штаммов относились к гаплотипу Н58, так называемому успешному азиатскому клону — международному клону высокого риска пандемического распространения. Он происходит из стран Юго-Восточной и Южной Азии.
В заключение доклада Лидия Алексеевна поделилась информацией о монофазной Salmonella enterica серовар Typhimurium — новом возбудителе пищевых вспышек в Европе. В марте 2022 году в Великобритании были зарегистрированы многочисленные случаи сальмонеллеза, возбудитель — S. Typhimurium сиквенс-типа 34 с множественной резистентностью к антибиотикам. Болели дети младше 10 лет, при этом 41 % больных госпитализировали. Исследования указали на связь вспышки с шоколадной продукцией бельгийского производства, которая продавалась в 113 странах. В апреле международная сеть по безопасности пищевых продуктов (ИНФОСАН) выпустила глобальное предупреждение об отзыве данной продукции по всему миру, а 11 стран сообщили о 151 генетически связанном случае заболевания, предположительно вызванного данным шоколадом. Четыре таких штамма были выделены в Санкт-Петербурге. Сейчас риск распространения инфекции в Европе и во всем мире оценивается как умеренный.
Председатель секции Александр Подколзин прокомментировал, что в последнее время в центр по сальмонеллезам стали поступать обращения, связанные с ложноотрицательными результатами при выявлении сальмонелл молекулярными тестами. С одной стороны, сальмонеллы характеризуются самой низкой концентрацией в клиническом материале среди бактериальных патогенов. С другой стороны, в последние годы появились наборы с упрощенной пробоподготовкой, которая не позволяет полностью удалить вещества, ингибирующие ПЦР. Получается, что в погоне за удобством и скоростью лаборатория жертвует качеством результата.
Следующая докладчица, д.м.н. Мария Макарова, рассказала о том, какие методы они с коллегами используют для изучения циркуляции патогеннных Escherichia coli на территории России.
 Мария Макарова
Мария Макарова
Огромную популяцию эшерихий в зависимости от наличия факторов вирулентности классифицируют на субпопуляции. В первую очередь это комменсалы (представители нормобиоты кишечника). В результате эволюции этого микроорганизма появились патогенные штаммы, такие как возбудители острых кишечных инфекций (ОКИ) — диареегенные E. coli (DEC), внекишечных инфекций (ExPEC) и инфекций, связанных с оказанием медицинской помощи (ИСМП). За счет того, что этот микроорганизм постоянно эволюционирует и резистентность к антимикробным препаратам перестает для него быть конечным этапом эволюции, появляются «гибридные» штаммы, которые сочетают в себе признаки разных субпопуляций.
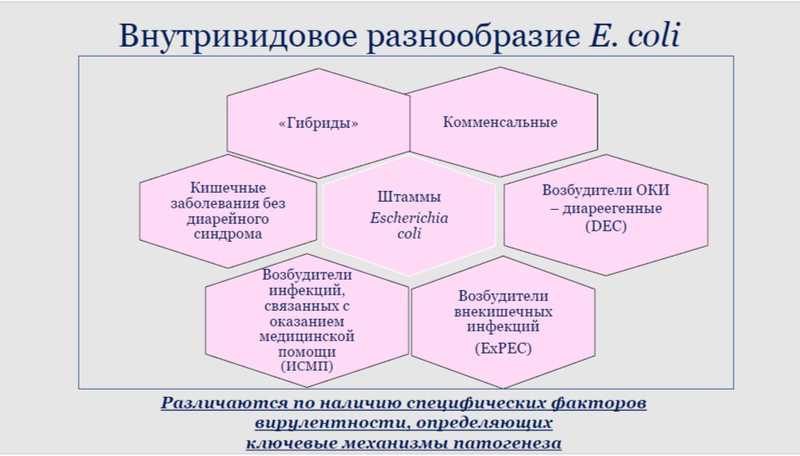
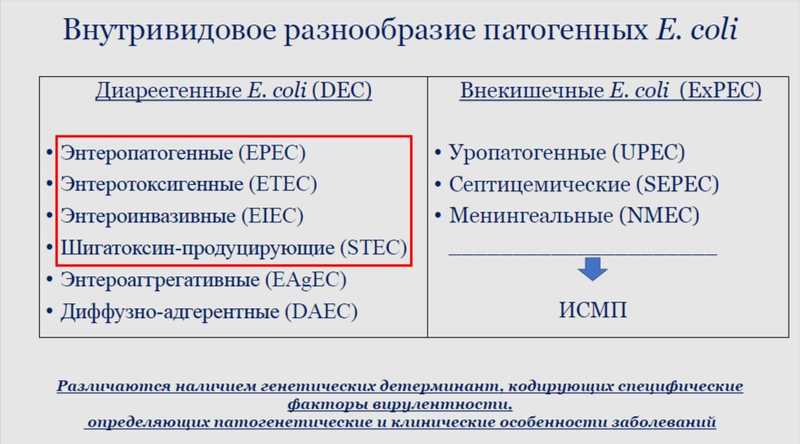
Культуральным методом специалисты не могут отличить патогенную эшерихию от авирулентной или от той, которая вызывает внекишечные заболевания. E. coli можно различить только с помощью молекулярно-генетических методов — для каждой конкретной патогруппы характерен свой определенный набор генов вирулентности. Культуральный метод является золотым стандартом для исследователей, но в современном мире странно выдавать ответ пациенту с диарейным синдромом на четвертые сутки. На сегодняшний день предпочтительно комбинировать молекулярно-генетические и культуральные методы – врачу нужно выдать результат как можно раньше, но дальнейшие исследования, например, определение чувствительности к АПМ или секвенирование, требуют выделения чистой культуры.
В качестве примера Мария Александровна упомянула E. coli серогруппы O26. Если бы бактериологи использовали только культуральный метод, то они зарегистрировали бы ее как энтеропатогенную — возбудителя колиэнтеритов у детей раннего возраста. Если бы они использовали генетический метод, то смогли бы определить, что она относится к сероварианту H11. В пределах этого сероварианта эшерихии могут принадлежать к трем патогруппам. Они могут быть энтеропатогенными, атипичными энтеропатогенными или шиготоксин-продуцирующими. Это обязательно нужно учитывать, поскольку назначение врачом антибактериальных пациентов может привести к тяжелейшему осложнению — гемолитико-уремическому синдрому.
В отличие от энтеропатогенных, источником атипичных энтеропатогенных или шиготоксин-продуцирующих E. сoli является крупный рогатый скот, а фактором передачи — пищевые продукты. Сегодня шиготоксин-продуцирующие эшерихии передаются не только через молочную продукцию, но и через ростки клевера, зеленый салат, зеленый горошек, арахисовое масло или даже мясо бизона. Мария Александровна и ее коллеги охарактеризовали штаммы, которые они выделили в Санкт-Петербурге и на северо-западе нашей страны. Они относятся к сиквенс-типу 21 и идентичны штаммам, циркулирующим в Японии, США и Канаде, то есть являются международным успешным клоном, способным к эпидемическому распространению и вызывающему заболевания у жителей всех континентов.
Другой пример — E. coli сиквенс-типа 131, изначально вызывавшая заболевания внекишечной локализации у амбулаторных пациентов. Сегодня это ведущий возбудитель инфекций, связанных с оказанием медицинской помощи в условиях стационара. По последним данным он может быть выделен не только от человека, но и от домашних и сельскохозяйственных животных, а также из объектов окружающей среды.
К сиквенс-типу 131 относятся эшерихии серологической группы О25. Нередко, когда этого возбудителя выделяют из кишечника, его регистрируют как энтеротоксигенную эшерихию, не обращая внимания на то, что этот штамм резистентен к широкому спектру антибактериальных препаратов. Так, при выделении О25, особенно в условиях детского стационара, некорректно рассматривать это как вспышку острой кишечной инфекции — это вспышка ИСМП. Порядка 26 % штаммов сиквенс-типа 131 Мария Макарова с коллегами выделили от больных внебольничными гнойно-септическим инфекциями — заболевания мочевыводящих путей, аппендициты, перитониты. В зарубежной литературе описаны вспышки этих инфекций, связанные с употреблением мясных продуктов, контаминированных штаммами E. coli сиквенс-типа 131.
В заключение доклада Мария Александровна рассказала об энтероаггрегативной E. coli сиквенс-типа 38. От классических эшерихий она отличается большим набором факторов вирулентности. По сути, она является супербактерией, которая может вызывать диарейный синдром, инфекцию мочевыводящих путей, а в условиях стационара — ИСМП.
Доклад к.б.н. Екатерины Воскресенской был посвящен молекулярно-генетическим исследованиям в мониторинге и диагностике иерсиниозов.
 Екатерина Воскресенская
Екатерина Воскресенская
Иерсинии (Y. enterocolitica и Y. pseudotuberculosis) повсеместно распространены на территории России. В зависимости от наличия основных детерминант патогенности (суперантигенов YPMa, YPMa и «острова высокой патогенности» HPI) Y. pseudotuberculosis подразделяют на 6 генетических групп, при этом основное значение в патологии человека имеют две. Группа G2 распространена в Европе, Австралии, Северной Америке и вызывает в основном гастроинтестинальные симптомы заболевания. В России, Японии и Корее выявляют штаммы группы G3, которые вызывают наряду с гастроинтестинальными симптомами также проявления системной инфекции – именно такое клиническое течение заболевания характерно для 90% штаммов, которые выделяются на территории нашей страны.
Екатерина Александровна и ее коллеги изучили штаммы Y. pseudotuberculosis, выделенные на территории Санкт-Петербурга за 90 лет — с 1926 по 2016 годы. Наряду с выявлением штаммов типичной для нашей станы генетической группы G3, в 30% случаев были обнаружены штаммы группы G2, причем достаточно высокий процент — у грызунов (источников инфекции). Поэтому целесообразно проводить обследование на псевдотуберкулез больных с гастроинтестинальными симптомами, с проявлениями ОКИ неустановленной этиологии и пациентов с диагнозом «острый аппендицит».
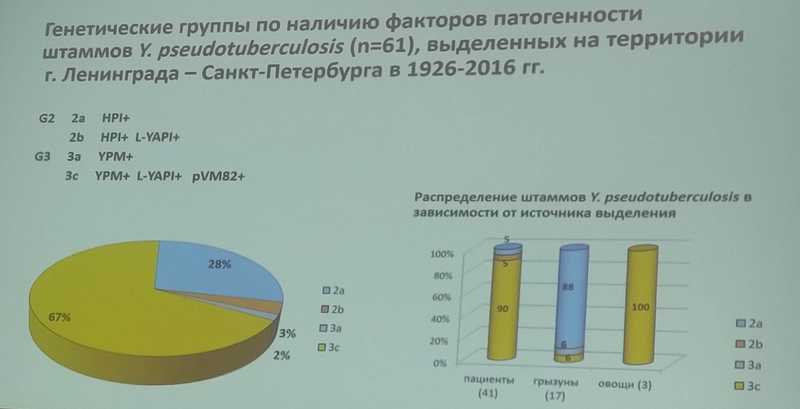
Далее Екатерина Александровна рассказала о результатах О-генотипирования обнаруженных в нашей стране штаммов Y. pseudotuberculosis с помощью метода мультипраймерной ПЦР — альтернативы классическим методам серотипирования. На территории России выявлены штаммы 6 серологических вариантов. Наибольшее разнообразие штаммов отмечено на Дальнем Востоке, меньшее — в Сибири и Санкт-Петербурге, но все регионы характеризуются преобладанием серотипа О:1b (57—95 %).
В целом генотипические характеристики штаммов (О-генотип, геногруппа на основе факторов патогенности) являются информативными молекулярными маркерами и могут быть использованы при проведении эпидемиологических расследований и обследовании спорадических больных. Несмотря на это, специалисты из НИИЭМ им. Пастера применили методы риботипирования и IS-RLFP-типирования для исследования 273 штаммов, выделенных в России и еще 24 странах во время вспышек и от спорадических больных. Оказалось, что штаммы, выявленные на территории нашей страны, существенно отличаются от тех, которые были обнаружены в других регионах мира. Примерно 93% исследованных штаммов входили в отдельный кластер, и только 7 % обладали генетическими характеристиками, близкими штаммам из других стран.
Поскольку не все эти методы доступны для лабораторий любого уровня, исследователи разработали в качестве скринингового метода для первичной дифференциации штаммов новый способ, основанный на выявлении индел-маркеров с помощью ПЦР. Большинство протестированных штаммов относились к одному индел-типу и соответствовали О:1b, а всего было выявлено шесть таких типов.
Штаммы Y. enterocolitica можно разделить на непатогенные и патогенные, причем среди последних выделяют пять биотипов и ряд серологических групп. Для России характерны серотипы О:3 и О:9, в Европе встречаются О:5,27, в то время как О:8 обнаружен на американском континенте. Кишечный иерсиниоз в нашей стране главным образом проявляется спорадическими случаями, однако в декабре прошлого года специалисты из НИИЭМ им. Пастера принимали участие в расследовании вспышки в Республике Алтай. Они провели core-genome SNP-типирование и подтвердили эпидемиологическую связь штаммов от источника инфекции (полевка), фактора передачи (картофель и свекла) и заболевшего человека. Выделенные штаммы отличались от тех, что были взяты для сравнения, и сформировали отдельную кладу на дендрограмме.
В следующем докладе Татьяна Сашина, к.б.н., сотрудник Нижегородского НИИЭМ им. академика И.Н. Блохиной, рассказала о методических подходах к изучению разнообразия ротавирусов и широком распространении в Нижнем Новгороде и Москве нового генетического варианта.
 Татьяна Сашина
Татьяна Сашина
Одна из основных особенностей ротавирусов является сегментированный геном, состоящий из 11 сегментов днРНК. Это обеспечивает их способность к реассортации — пересортировке сегментов генома при одновременном инфицировании клетки двумя или более штаммами. В этом случае вирусное потомство (реассортанты) получает смешанный набор генов родительских штаммов. Принимая во внимание эту особенность, специалисты применяют две системы классификации ротавирусов — классическую бинарную и современную полногеномную.

Татьяна Александровна подчеркнула важность использования последней для характеристики штаммов. Только основываясь на полном генотипе, можно выявить реассортантный вариант ротавируса, который впервые был обнаружен в 2013 году в Австралии, впоследствии распространился по всему миру, а с 2022 года доминирует и в России.
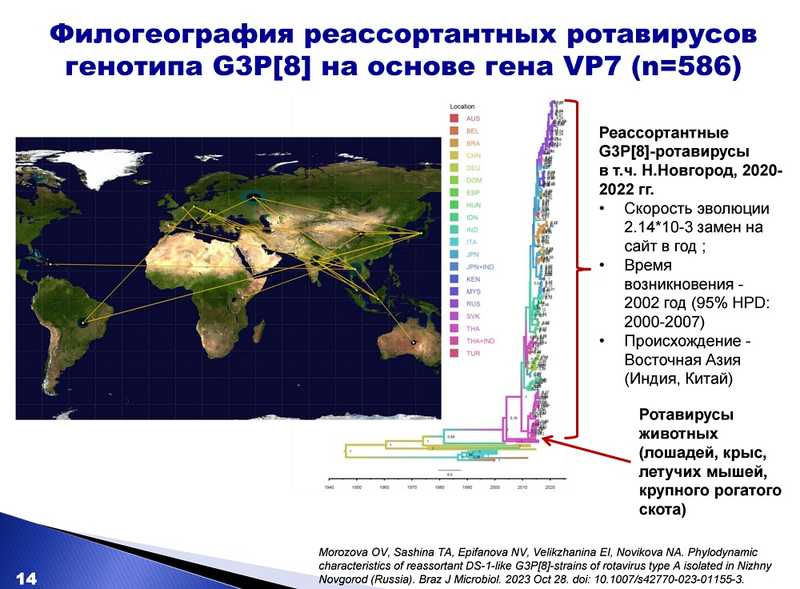
Сотрудники ННИИЭМ провели детальное изучение этого нового варианта генотипа G3P[8] на основе всех 11 сегментов генома. В выборку для анализа они взяли штаммы того периода, когда вариант был впервые выявлен в Нижнем Новгороде (2016-2019 гг.) Оказалось, что реассортанты не родственны местным штаммам ни по одному из генов. Они группировались на филогенетических деревьях вместе с аналогичными штаммами из других стран, с которыми формировали отдельные кластеры. Это позволило предположить, что реассортантный вариант был занесен на территорию России.

Далее специалисты провели филодинамическое и филогеографическое моделирование, основываясь на 586 полных нуклеотидных последовательностях гена VP7 ротавирусов из разных стран. Они взяли в анализ более поздние штаммы из Нижнего Новгорода, выявленные в период 2020-2022 гг., включающий время их доминирования. Им удалось установить, что данный вариант возник около 2002 года в Восточной Азии, а источником его происхождения были ротавирусы животных. Достоверно выяснить, откуда произошел занос реассортантного ротавируса в Россию, не представляется возможным, но были показаны статистически значимые связи с Японией и Таиландом. Также сотрудники ННИИЭМ обнаружили свидетельства того, что в локальных популяциях ротавирусов происходит дальнейшая эволюция этого варианта путем реассортации.
Появление и распространение новых вариантов необходимо учитывать, так как антигенные изменения теоретически могут привести к ускользанию таких вирусов от иммунитета, сформированного вакциной. Белок VP7 — один из основных антигенов ротавирусов, которые распознаются антителами. Поэтому во второй части доклада Татьяна Александровна привела результаты сравнения антигенных эпитопов на поверхности этого белка для ротавирусов, циркулирующих в России, в том числе нового варианта, и штаммов-компонентов вакцин, применяемых в мире. Были впервые озвучены данные относительно штаммов, послуживших основой для индийской вакцины Рота-V-Эйд, которая была разрешена для применения в России совсем недавно, в 2021 году. Несмотря на обнаруженные замены аминокислот, применение вакцин является необходимым, эффективным и экономически оправданным. Однако важен постоянный мониторинг циркулирующих ротавирусов для изучения их будущих генетических изменений.
В завершение секции сотрудники Центра стратегического планирования и управления медико-биологическими рисками здоровью рассказали о новых методах выявления энтеровирусов и возбудителей кишечных инфекций в целом.
Доклад Валерии Поляковой был посвящен разработке тест-системы для выявления РНК энтеровирусов с дифференциацией энтеровируса 68-го типа методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией в реальном времени.
Энтеровирусы видов А, B, C и D могут вызывать большой спектр заболеваний, которые варьируют от легких респираторных проявлений, лихорадки и везикулярного фарингита до серьезных форм инфекции, связанных с поражениями ЦНС. Энтеровирус D68 впервые был выявлен в 60-х годах XX века и связан с респираторными заболеваниями. Начиная с 2000-х годов число случаев заболеваний этим вирусом резко возросло и расширилась география его циркуляции. Особая настороженность по отношению к энтеровирусу D68 связана с его тропностью к нервной ткани, например, в 2014 году в США у 120 инфицированных детей после разрешения респираторных проявлений диагностировали острый вялый миелит вследствие повреждения серого вещества спинного мозга. В России в 2022 году было обнаружено 25 изолятов энтеровируса D68.
Предварительно разработчики тест-системы секвенировали по методу Сэнгера участки 5’-UTR и VP1 генома для 131 изолята энтеровирусов, чтобы при подборе праймеров учесть значимые полиморфизмы. Материалом для исследования послужили образцы, собранные в Москве с октября 2021 года по ноябрь 2022 года, среди которых было обнаружено 8 вирусов D68. Праймеры и зонды в новой тест-системе нацелены на консервативную область 5’-UTR генома энтеровирусов. Они подобраны таким образом, чтобы исключить выявление близкородственных энтеровирусам риновирусов и дифференцировать энтеровирус D68. В разработанной тест-системе по каналу FAM регистрируется кДНК внутреннего контрольного образца, по каналу HEX — кДНК энтеровирусов видов А, B, C и D, а по каналу Cy5 — кДНК вируса D68.
Для проверки аналитической чувствительности набора использовали клинический материал, который был контаминирован положительным контрольным образцом с известной концентрацией, содержащим фрагмент РНК энтеровируса D68 в MS2-фаге. Набор позволяет выявлять РНК энтеровируса из мазков со слизистой носо- и ротоглотки, спинномозговой жидкости, фекалий и имеет предел обнаружения 5*10-3 ГЭ/мл. Для оценки аналитической специфичности набора разработчики использовали панель вирусных штаммов, включающую энтреровирусы, риновирусы, пареховирусы, аденовирусы, коронавирусы и другие, и показали отсутствие перекрестных реакций. Диагностическую чувствительность и специфичность набора протестировали на 701 предварительно охарактеризованных клинических образцах.
В последнем докладе Анна Толоконцева обсудила перспективы применения мультиплексной изотермической амплификации для выявления возбудителей кишечных инфекций.
 Анна Толоконцева
Анна Толоконцева
В настоящее время актуальна разработка простых и современных методов, которые по чувствительности и специфичности не будут уступать ПЦР, но помогут вывести диагностику ОКИ на более быстрый уровень, чтобы ее можно было проводить непосредственно в лечебных учреждениях. Один из таких методов — петлевая изотермическая амплификация (LAMP). В нем используются ДНК-полимераза с вытесняющей активностью в присутствии прямых, обратных и петлевых праймеров, что ускоряет реакцию. К преимуществам метода относятся быстрота выполнения (время реакции 20–40 минут), температурный режим, высокая чувствительность и специфичность, а также возможность визуальной детекции по конечной точке и использования с портативным оборудованием.
Исходя из их актуальности, разработчики выбрали детектируемых возбудителей ОКИ для будущей тест-системы (Shigella spp., энтероинвазивная кишечная палочка, термофильные Campylobacter spp., Salmonella spp. и аденовирус F 40/41) и гены-мишени для них. Для вирусов с высоковариабельным геномом, таких как ротавирусы и норовирусы, методика LAMP оказалась малоэффективной и показала низкую чувствительность, поэтому для них целесообразно использовать другие изотермические методы амплификации.
Следующим этапом разработки системы стал выбор праймер-зонда для LAMP. Анна Андреевна и её коллеги протестировали два подхода, описанные в литературе, и в дальнейшей работе использовали тот, который позволил получить наибольшую скорость реакции (15 минут). После этого разработчики проанализировали сочетание мишеней и снизили концентрацию праймеров на 30–60% в каждой смеси, чтобы мультиплексировать реакцию. Это повлияло и на уровень флуоресценции, и на скорость реакции. Анна Андреевна обратила внимание, что мультиплексирование LAMP возможно, но требует более тщательного подбора концентрации компонентов из-за их сильного взаимного влияния.
В итоговом дизайне тест-системы одна смесь служит для детекции ДНК шигелл и термофильных кампилобактерий в присутствии внутреннего контрольного образца, а вторая — для выявления ДНК аденовирусов и сальмонелл. Анна Андреевна и ее коллеги протестировали набор на 80 клинических образцах от детей с симптомами ОКИ. Наличие генетического материала возбудителей ОКИ в образцах они подтверждали, используя ПЦР-набор «ОКИ-скрин-FL». Аналитическая чувствительность тест системы для всех мишеней была 5*10-3 копий/мл. Далее они проверили ее аналитическую специфичность на обширной панели вирусов и бактерий, включающей в том числе представителей кишечной микрофлоры. Разработчики не выявили перекрестных реакций, однако им пришлось увеличить время амплификации до 60 минут. Диагностическая чувствительность и специфичность новой тест-системы оказалась сопоставимой с набором реагентов «ОКИ-скрин-FL».
В завершение секции слушатели и Лидия Кафтырева обсудили информацию по прошедшей в сентябре в Санкт-Петербурге вспышке сальмонеллеза, ассоциированной с вафлями. Были нарушены технология их приготовления по французскому рецепту, сроки доставки и реализации. Заболело около 300 человек. Когда материал от заболевших был исследован методом секвенирования, специалисты увидели, что на самом деле это были две вспышки, ассоциированные с двумя различными генетическими линиями возбудителя.
Информация о докладчиках
Лидия Алексеевна Кафтырева, д.м.н., профессор, Санкт-Петербургский НИИ эпидемиологии и микробиологии им. Пастера Роспотребнадзора
Мария Александровна Макарова, д.м.н., Санкт-Петербургский НИИ эпидемиологии и микробиологии им. Пастера Роспотребнадзора
Екатерина Александровна Воскресенская, к.б.н., Санкт-Петербургский НИИ эпидемиологии и микробиологии им. Пастера Роспотребнадзора
Татьяна Александровна Сашина, к.б.н., Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н.Блохиной Роспотребнадзора
Валерия Александровна Полякова, Центр стратегического планирования и управления медико-биологическими рисками здоровью ФМБА России
Анна Андреевна Толоконцева, Центр стратегического планирования и управления медико-биологическими рисками здоровью ФМБА России


 Меню
Меню





 Все темы
Все темы




 0
0