МД-2023: Онкогенетика
Какие мишени считаются агностическими и почему для них, несмотря на название, все-таки зачастую важен тканевый контекст? Чем хороши in-house NGS методы для диагностики онкозаболеваний? Какие маркеры служат прогностическими для диффузной B-крупноклеточной лимфомы? Эти вопросы, а также правовое регулирование молекулярно-генетических исследований, важность преаналитики и многое другое рассмотрели на секции «Молекулярно-генетические исследования в онкологии и гематологии».

Кроме того, важна информационная поддержка используемых препаратов, таргетирующих те или иные мишени. Примером могут служить транслокации в NTRK — на них направлены два новых препарата, — а само выявление транслокаций в NTRK считается агностическим тестом. Тем не менее, сам вариант считается редким, и частота этих транслокаций при раке легкого на самом деле низкая. Это ставит важный вопрос: когда целесообразно проводить тесты? С одной стороны, обнаружение агностической мишени позволит подобрать эффективную терапию, с другой, необходимо учитывать также ресурсозатратность этих анализов. Их проведение стоит того, когда речь идет о любых педиатрических опухолях и о любых саркомах. При них вероятность обнаружить транслокацию составляет около 5%, и в случае обнаружения можно ожидать очень хорошего ответа на соответствующую терапию.
Некоторые мутации имеют условно-агностическое значение — их клиническая значимость определяется тканевым и опухолевым окружением. Так, эффективность ингибиторов BRAF, мутация которого встречается в меланомах, очень высока при этом типе рака. При другой разновидности — раке толстой кишки — таргетирование мутаций в этом же гене оказывается куда менее успешным, поскольку в опухолях также присутствует коллатераль в виде EGFR, и такой рак требует сочетанной терапии. Таким образом, эффективность подобных мишеней может на порядок зависеть от тканевого контекста.
Также существуют агностические данные и по мутационной нагрузке опухоли — при микросателлитной нестабильности число мутаций может доходить до сотни на млн.п.о., и такой уровень мутационной нагрузки ассоциирован с ответом на иммунотерапию. Однако в целом совокупная мутационная нагрузка, если речь о более широком ее спектре, не может считаться агностическим маркером.
Один из набирающих популярность подходов к поиску терапии — это комплексное геномное профилирование, при котором в панель входит множество мишеней, свойственных различным типам рака. Несмотря на перспективность, на сегодняшний день такой подход не лишен недостатков. Существующие панели содержат не только истинные мишени, но и те, которые не имеют клинической значимости. Кроме того, вопрос целесообразности применений этой затратной диагностики все еще стоит остро. В качестве примера можно рассмотреть результаты клинических испытаний таких панелей при раке молочной железы. Из значимых мишеней в ходе тестирования выявили варианты, которые следует искать и без применения панельного тестирования — мутации в PI3K и BRCA1/2. Во всех остальных случаях результаты исследования оказались бессмысленны, и не было статистически значимой разницы между использованием эмпирически подобранной терапии и лечением, основанным на результатах тестирования.
Организационные проблемы молекулярно-генетических исследований в онкологии подняла в своем докладе Ирина Демидова, заведующая лабораторией молекулярной биологии Московской городской онкологической больницы № 62.
Распространенное прикладное применение молекулярной генетики — диагностика врожденных или наследственных заболеваний. На втором месте стоит оказание помощи пациентам с онкологическими и онкогематологическими заболеваниями. Также эти исследования применяются в диагностике соматических состояний, например, в кардиологии и эндокринологии. Однако в большинстве случаев они не регламентируются современными клиническими рекомендациями.
Приказ Минздрава №274 «Об утверждении Порядка оказания медицинской помощи пациентам с врожденными и (или) наследственными заболеваниями» — основной правовой документ, регулирующий медицинскую генетику. Этот Порядок важен для тех, кто действительно работает с наследственными генетическими патологиями, и совершенно не подходит к онкологии и онкогематологии. Почему этот закон не может быть применен для регуляции данных медицинских исследований? Он предусматривает диагностику исключительно врожденных или наследственных заболеваний,не имеет прямых указаний на возможность определения даже наследственных онкологических синдромов, хотя напрямую и не запрещает эти исследования. Речь в данном случае идет в основном о диагностике в рамках пренатального и неонатального скрининга — Порядок регулирует работу медицинских организаций, которые входят, как правило, в состав медико-генетических консультаций. В нем перечислен полный список заболеваний, которые подпадают под этот закон.
Приказ №179 «О Правилах проведения патолого-анатомических исследований» также не регулирует в полной мере проведение молекулярно-генетических исследований в онкологии и онкогематологии. Он регламентирует только работу с биопсийным и операционным материалом, а данные исследования не сводятся исключительно к ним. Кроме того, стандарт оснащения патолого-анатомических отделений не предусматривает специального оборудования для молекулярной генетики.
Таким образом, имеющаяся на сегодняшний день правовая база, к сожалению, не обеспечивает полноценной регуляции молекулярно-генетических исследований в онкологии.
Ирина Демидова также привела доклады двух ведущих специалистов: замминистра здравоохранения Е. Г. Камкина и директора Федерального учреждения медико-генетических научных центров С. И. Куцева. По их данным, к 2019 году численность врачей-генетиков составляла 330 человек, лабораторных генетиков — 227. Рекомендованная укомплектованность штата генетиками не превышала 64%, и обеспечить проведение всех молекулярно-генетических исследований такими силами невозможно.
Молекулярно-генетические исследования с целью выявления онкологических заболеваний и подбора таргетной терапии с 2020 оплачиваются по программе госгарантий, однако после введения такой программы регионы столкнулись с отсутствием единого правового документа, который бы регулировал правила проведения исследований и формирование тарифов на них.
Чтобы поправить сложившееся положение, сформированная по просьбе Минздрава группа экспертов создала рабочий вариант Правил проведения молекулярно-генетических исследований, который был направлен в Минздрав РФ с целью либо создания приложения к новому Приказу по клинико-лабораторной диагностике, либо формирования отдельного документа.
Про диагностику рака по циркулирующей опухолевой ДНК (цДНК) и важность преаналитического этапа в таких исследованиях рассказал Алексей Баринов (Московская городская онкологическая больница № 62). Вопрос преаналитики не так часто поднимается в практике, несмотря на всю его важность — ошибки, допущенные в ходе пробоподготовки, могут сильно исказить результаты анализа. Помимо внеклеточной ДНК, в крови присутствуют и ДНК-содержащие клетки — клетки лимфоцитарного ряда. Количество ДНК, содержащаяся в них, во много раз превышает количество внеклеточной ДНК. Уровень последней со временем не изменяется, а вот количество вышедшей из клеток ДНК в пробе способно многократно возрастать, когда целостность клеток нарушается. Классическая ошибка описана в исследованиии определения пола методом ПЦР-диагностики локусов на Y-хромосоме. В таком, казалось бы, несложном тестировании чувствительность в некоторых лабораториях не превышала 50-60%. По-видимому, это было связано с недостаточно строгим соблюдением преаналитических этапов, что приводило к высокой частоте ложноотрицательных результатов — локусы Y-хромосомы не были детектированы при беременности мальчиком.
В онкологии же цДНК часто используется в случаях, когда взятие биопсии затруднено, или служит дополнением к нему. При раке легкого анализ цДНК помогает решить вопросы, связанные с таргетной терапией и выбором препарата. Для стандартизации преаналитического этапа существуют специальные пробирки для цДНК, и Алексей Баринов поделился опытом их тестирования. Производитель заявляет, что время до выделения ДНК из образцов, собранных в такие пробирки, может составлять до недели, и это не скажется на качестве результатов.
В схему исследования вошли 15 пациентов с метастатическим колоректальным раком, у каждого пациента собирали образцы крови, и анализ цДНК проводили на нулевой и седьмой день после отбора. В исследование входило измерение концентрации выделенной цДНК, фрагментный анализ, определение индекса деградации и оценка пригодности выделенной ДНК для секвенирования. Концентрация на нулевой и седьмой дни не отличалась — это говорит о том, что спустя неделю хранения образца в пробирке не происходит контаминации клеточной ДНК. И в тех, и в других в образцах содержались короткие (170220 п.н.) фрагменты, которые соответствовали по размерам цДНК. Кроме того, не было выявлено существенных отличий по индексу деградации. Его можно определить методом ПЦР с ампликонами разной длины. Этот индекс менялся со временем, но незначительно — это указывает на то, что пробирки скорее всего эффективны. Конечно, использование подобных пробирок — это не единственный подход к решению проблемы. При проведении лабораторных исследований требуется выполнять внешний и внутренний контроль качества. В частности, полезным этапом было бы использование стандартных образцов для сравнения, однако для цДНК такие образцы не разработаны до сих пор.
Следующий доклад был посвящен использованию РНК в качестве диагностических маркеров в онкогематологии. Игорь Ольховский из ФГБУ «НМИЦ гематологии» (г. Красноярск) на примере передачи сигнала от B-клеточного рецептора подчеркнул сложность многих сигнальных процессов и систем клетки. Он обратил внимание слушателей на то, что все белки-участники сигналинга зависят от деятельности другой информационной системы — разнообразных клеточных РНК.
Один из путей пространственной регуляции может быть основан на кольцевых РНК, которые хорошо способны связывать другие молекулы РНК или белков. Модели 3D-вариантов их взаимного расположения описывает теория узлов — так, провзаимодействовав с микроРНК, кольцевая молекула примет такую форму, что доступность этой микроРНК будет ограничена или появится место для связывания третьей молекулы РНК. Прочтение таких 3D РНК-«иероглифов» биоинформатическими методами может сыграть важную роль в будущей диагностике рака.
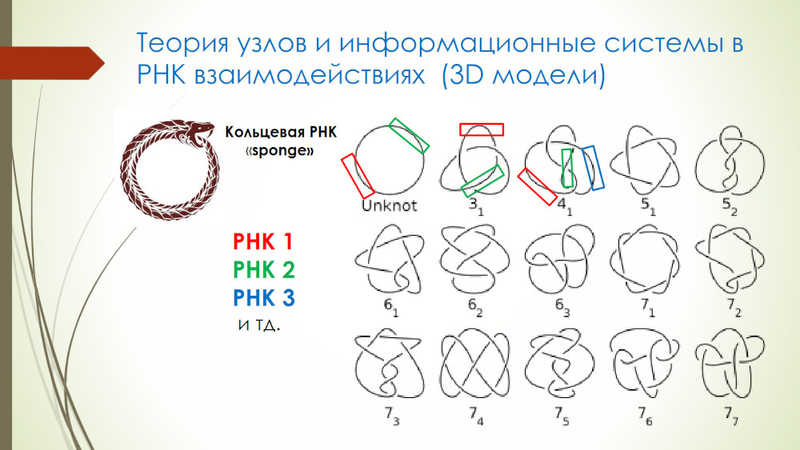
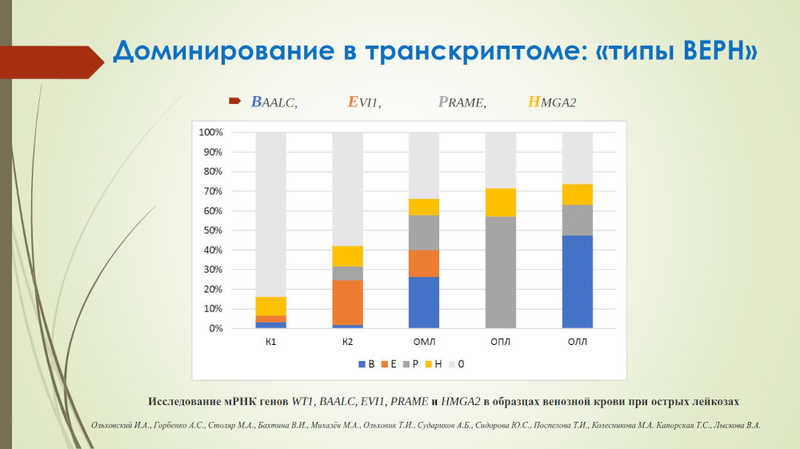
В настоящий момент выявлен целый ряд РНК, так или иначе ассоциированных с онкозаболеваниями. В частности, существует предположение, что клональные клетки имеют устойчивое соотношение активности генов и уровня экспрессии отдельных РНК — это может определять клинические особенности. Это демонстрируют так называемые «типы ВЕРН» — соотношения мРНК генов WT1, BAALC, EVI1, PRAME и HMGA2 — в образцах венозной крови пациентов. Определенные их пропорции характерны для острого миелоидного или острого лимфобластного лейкоза, тогда как другие варианты могут указывать на особый подвид — острый промиелоцитарный лейкоз. В настоящий момент продолжаются исследования, направленные на то, чтобы выяснить, могут ли эти соотношения являться также прогностическими маркерами.
Таким образом, идентификация РНК-маркеров — это перспективное направление в клинической лабораторной диагностике, ограниченное, однако, рядом препятствий. Аналитические методы работы с РНК-маркерами не стандартизованы, и самих клинических исследований, на результаты которых можно было бы опираться при диагностике, пока еще недостаточно. Кроме того, для широкого внедрения таких подходов требуются доступные коммерческие тест-системы, которых в настоящее время недостает.
Однако опираться в выявлении опухолей можно не только на коммерческие наборы, но и на «домашние решения». Именно им был посвящен доклад Андрея Сударикова (ФГБУ «НМИЦ Гематологии», г. Москва), темой которого стало in-house NGS для диагностики онкогематологических заболеваний.
Благодаря секвенированию и проекту «Геном человека» нам доступна информация о последовательностях (и вариантах) генов человека, однако для получения значимых результатов полногеномные исследования требуют значительных выборок, которые в онкогематологии часто недоступны. Наибольшую эффективность здесь, по-видимому, имеют диагностические исследования известных мишеней или поисковые научные исследования в неких «генах интереса». И, конечно, в современном мире существуют коммерческие варианты для проведения секвенирования, которые обладают своими преимуществами — это решения «под ключ», обладающие относительной простотой входа и позволяющие секвенировать большое число мишеней при низком расходе ДНК. Альтернативой им служат in-house варианты. Они требуют от специалиста навыков грамотного приготовления библиотек для секвенирования, контроля качества и обработки результатов, но при этом доступнее и дешевле, чем коммерческие решения. Кроме того, их проще масштабировать и комбинировать между собой.
Таргетное NGS применяют, например, при многоэкзонном секвенировании — гены таких ассоциированных с онкозаболеваниями белков, как TP53 или DNMT3A, содержат большое количество экзонов. Также его используют в случаях, когда нужно определить варианты с частотой встречаемости аллеля менее 15%, если только речь не идет о мутациях в горячих точках, на которые можно провести аллель-специфичную ПЦР. Кроме того, когда в запуске есть «свободное место», его можно занять любыми другими интересующими таргетами — и это снова возвращает нас к вопросу об удобстве комбинирования, когда речь идет о домашнем секвенировании.
Таким образом, на сегодняшний день in-house NGS имеет несколько преимуществ. Во-первых, оно позволяет экономить трудовые и материальные затраты при секвенировании мишеней из многих экзонов. Во-вторых, обеспечивает корректную диагностику в случаях, когда варианты не разрешаются по Сэнгеру. И, наконец, домашнее таргетное секвенирование обеспечивает возможность комбинирования различных анализов с последующим параллельным обсчетом результатов.
 Надежность in-house NGS проверена в рамках различных международных сертификаций, подтверждающих соответствие методов международным стандартам.
Надежность in-house NGS проверена в рамках различных международных сертификаций, подтверждающих соответствие методов международным стандартам.
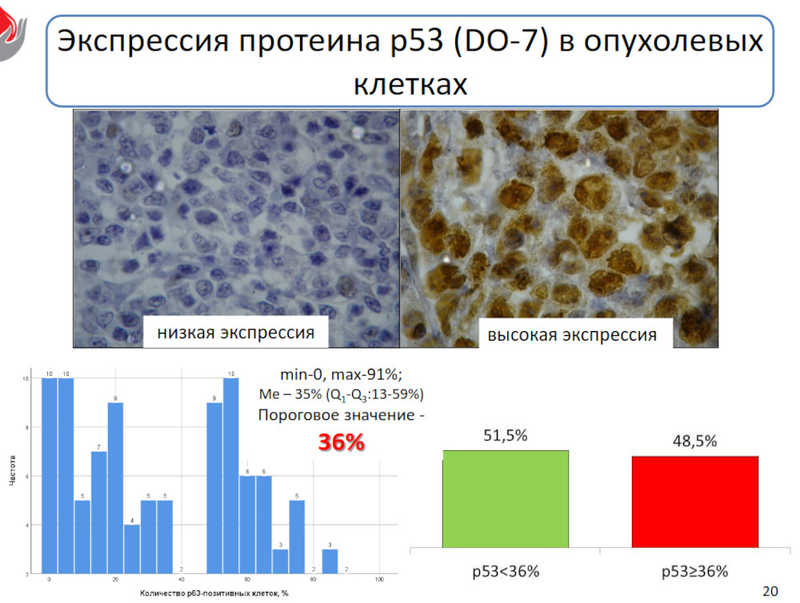
Исследовательский коллектив задался целью определить прогностическое значение аббераций в этих генах, а также экспрессии их белковых продуктов (р16INK4A, p14ARF, р53). Результаты исследования, проведенного на 103 пациентах с диффузной B-крупноклеточной лимфомой, показали следующее. Высокое (от 10%) количество р16INK4A+ опухолевых клеток ассоциировано с недостижением полного ответа на терапию по протоколу R-CHOP (сочетанная терапия ритуксимабом и химиотерапевтическими препаратами) и с низкой общей выживаемостью пациентов.
Высокая экспрессия TP53, как известно из литературных данных, может быть связана с мутациями в этом гене. Надпороговый уровень клеток, экспрессирующих p53 (более 36%), служит независимым прогностическим фактором, влияющим на пятилетнюю общую и беспрогрессивную выживаемость пациентов с диффузной B-крупноклеточной лимфомой — эти показатели были выше у пациентов с низким уровнем экспрессии этого белка.
Делеции CDKN2A/B по результатам проведенного анализа были ассоциированы с низким уровнем беспрогрессивной выживаемости пациентов. Сочетанные абберации CDKN2A/B и TP53 могут быть дополнительными предикторами низких показателей выживаемости, однако эти данные требуют подтверждения на большей выборке.
Заключительный доклад секции был посвящен метилированию ДНК в жидкостных биопсиях. Его прочитала Екатерина Грачева из компании Diagenode при поддержке Skygen. Компания работает со всеми основными направлениями в эпигенетике, включая хроматин, некодирующие РНК и метилирование ДНК. Различия в метилировании могут наблюдаться, в частности, между здоровыми и опухолевыми клетками. Они могут быть связаны с геномной нестабильностью и служить драйвером развития опухоли. Одно из перспективных направлений — это исследование циркулирующей внеклеточной ДНК (цДНК), количество которой увеличивается при прогрессировании многих видов рака. По цДНК можно установить ткань происхождения или определить молекулярный профиль опухоли. Кроме того, она появляется уже на ранних стадиях развития заболевания, что важно в случае солидных опухолей, которые зачастую диагностируются уже на достаточно поздних этапах, а ее сбор менее инвазивен, чем проведение биопсии. Однако при работе с цДНК речь идет о небольших (170–200 п.н.) фрагментах, которые присутствуют в крови в низкой (порядка нанограмм) концентрации, и большую ее часть составляет внеклеточная ДНК здоровых тканей, которую необходимо отличить от опухолевой.Один из существующих способов это сделать основан на профиле метилирования ДНК, и примером таких исследований служит КИ компании GRAIL, посвященное тому, возможно ли детектировать несколько видов опухолей по одному образцу крови. В КИ приняли участие 15 тысяч человек, 60% из которых имело различные онкологические заболевания. Метилирование ДНК надежно показывало присутствие опухолей различных типов и позволяло с высокой точностью определять их происхождение. Исследование продолжается, и его результаты ожидаются к следующему году. Как же создать подобный тест для выявления опухоли по цДНК?
Его разработка начинается с поиска кандидатных биомаркеров, которые затем необходимо проанализировать и валидировать наиболее перспективные варианты на большой когорте. Поиск биомаркеров требует выделения внеклеточной ДНК и выявления паттернов метилирования (этот этап подразумевает бисульфитное секвенирование — «золотой стандарт» анализа — или энзиматическую конверсию метилированных нуклеотидов), среди которых и ищут кандидатные варианты. Речь во многих случаях идет не о полногеномном, а о таргетном секвенировании с использованием, к примеру, панели Human methylome — это подразумевает в том числе более высокое покрытие при прочтении анализируемых участков. Выявленные паттерны метилирования могут быть ассоциированы с типом, стадией заболевания или прогноза (в случае хорошо охарактеризованных опухолей).
Информация о докладчиках
Имянитов Евгений Наумович, д.м.н., профессор, чл.-корр. РАН, ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Демидова Ирина Анатольевна, к.м.н., ГБУЗ «Московская городская онкологическая больница № 62 Департамента здравоохранения города Москвы»
Ольховский Игорь Алексеевич, к.м.н., ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, г. Красноярск
Баринов Алексей Андреевич, ГБУЗ «Московская городская онкологическая больница № 62 Департамента здравоохранения города Москвы»
Судариков Андрей Борисович, д.б.н., ФГБУ «НМИЦ гематологии» Минздрава России, г. Москва
Сарпова Мария Вадимовна, ФГБУН «Кировский научно-исследовательский институт гематологии и переливания крови ФМБА», г. Киров
Грачева Екатерина, Компания Diagenode. Доклад подготовлен при поддержке компании Skygen


 Меню
Меню





 Все темы
Все темы




 0
0