МД-2023: Респираторные заболевания после 2020 года
На секции «Респираторные заболевания на фоне динамичной циркуляции COVID-19» конференции «Молекулярная диагностика 2023» говорили о пневмонии, вызванной микоплазмой, и о листериозе, о генетических детерминантах тяжелого протекания COVID-19 и других инфекционных заболеваний. А еще о том, почему изменения микробиома дыхательных путей во время инфекции вызывают у исследователей ассоциации с «Анной Карениной».

Инна Эйдельштейн
Фото:
Денис Зыбин
Секцию открыл доклад Инны Эйдельштейн (НИИ антимикробной химиотерапии Смоленского государственного медицинского университета) о пневмонии, вызванной Mycoplasma pneumoniae, в том числе устойчивой к макролидам, у госпитализированных пациентов в Cмоленске (2022–2023 гг.).
Устойчивость к макролидам часто вызывается мутациями в гене 23S рРНК. Она описала семейный случай распространения устойчивой M. pneumoniae в 2018 году. Первому пациенту, 17-летнему мальчику с рентгенологически подтвержденной пневмонией, назначили азитромицин. На повторном обследовании взяли тест, выявили микоплазму. После курса лечения доминировала резистентная популяция, у микоплазмы выявили мутацию устойчивости, которая, по-видимому, появилась именно у этого пациента. Пневмония также началась у матери юноши (43 года), и у микоплазмы выявили ту же мутацию. Женщине сразу назначили фторхинолон (он разрешен для пациентов с 18 лет), и он оказался эффективным.
В другом случае проанализировали 28 детей с симптомами пневмонии, у которых после лечения сохранилась микоплазма. Инфицированные с маркерами резистентности — «это те, кто кашляет после выписки», — объяснила докладчица. M. pneumoniae продуцирует вещества, раздражающие слизистую дыхательных путей, пациенты надсадно кашляют и заражают других. Через 21 день детей направили на обследование, и у клинически здоровых детей был положительный тест на M. pneumoniae. Это подчеркивает важность длительного наблюдения пациента.
Затем докладчица сравнила ситуации с микоплазмой до 2020 года и после. Среди 1480 образцов, собранных до пандемии, 19% несли мутации устойчивости. Во время пандемии заболеваемость снизилась. В 2022-2023 году микоплазма снова появилась; в том числе устойчивая M. pneumoniae была обнаружена в воинской части.
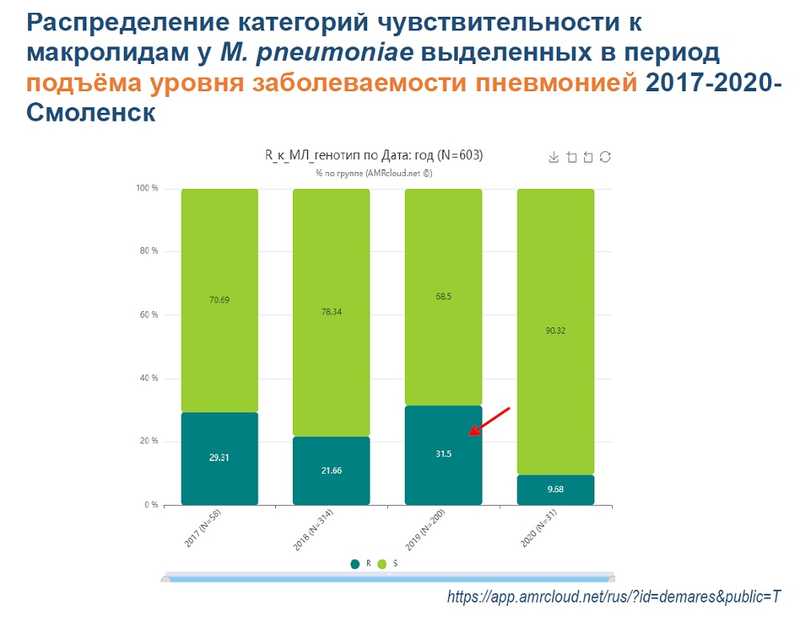
Клинические характеристики пневмонии, вызванной микоплазмой, не являются специфическими: лихорадка, сухой непродуктивный кашель. Однако многие врачи, как отметила докладчица, умеют «видеть» характерную клиническую картину и назначают левофлоксацин (препарат из группы фторхинолонов третьего поколения) сразу, не дожидаясь теста, и пациенты выздоравливают.
Тем не менее тесты на микоплазму необходимо включать в диагностические алгоритмы, подчеркнула Инна Эйдельштейн. Докладчица рассказала еще один случай: два студента, учившиеся в Москве, вернулись в Смоленск с кашлем. Респираторная панель показала присутствие микоплазмы дикого типа, но один молодой человек уже начал принимать амоксиклав, второй ципрофлоксацин (фторхинолон второго поколения). Препарат сменили на левофлоксацин, и пациенты выздоровели.
Ольга Воронина (НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России) сообщила, что листериоз не «затих» во время COVID-19, более того, пациенты, перенесшие коронавирусную инфекцию, являются группой риска, как и беременные, новорожденные и эмбрионы, лица пожилого возраста. Осложнением листериоза у пожилых и иммуносупрессивных пациентов может быть менингит.
В филогении Listeria monocytogenes выделяют первую и вторую линии, причем первая более вирулентна. Филогенетическая линия включает клональные комплексы и типы последовательностей (ST). При ковиде спектр генотипов изменился.
Инвазивный листериоз стал моложе, отметила докладчица; минимальный возраст пациента —3 года. При этом медиана возраста умерших в группе с диагнозом «менингит — септицемия» и ранее перенесенным COVID-19 — 76 лет, выздоровевших — около 36, то есть для пожилых инфекция опаснее, в целом же отмечается высокая смертность.
У беременных восприимчивость к листериозу повышена в 10-24 раз. Причины — сниженное содержание Т-клеток в периферической крови, особенно во втором и третьем триместре, уменьшение подвижности кишечника, необходимой для секреции мукуса, повышение веса, ассоциированное с неблагоприятными изменениями микробиома кишечника.
При перинатальном листериозе во время пандемии также стали регистрироваться новые генотипы. Исследование геномов говорит о том, что инфекция происходит из различных источников, а не из одного. У листерии регистрируются гены устойчивость к фосфомицину, линкозамиду, катионным пептидам, хинолонам. Изучение плазмидома обнаружило также гены устойчивости к кадмию и другим тяжелых металлов.
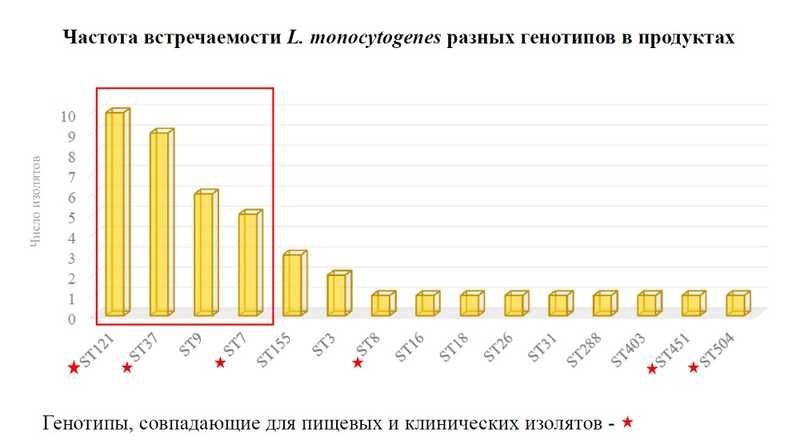
Как показало исследование частоты встречаемости различных генотипов в продуктах, среди них лидируют в том числе те, которые часто встречаются в клинических изолятах. Но весь этот спектр патогенов может вызвать инвазивный листериоз, так как чувствительность к инфекции повышена после COVID-19. Беременным следует избегать потребления продуктов без термообработки, подчеркнула Ольга Воронина.
Результаты исследования генетической предрасположенности к тяжелому течению СOVID-19 в российской популяции представила Мария Гусакова (ЦСП ФМБА России). Одна из загадок SARS-CoV-2 — почему одни люди болеют практически бессимптомно, а другие попадают в отделения интенсивной терапии. Возраст, курение, индекс массы тела, сопутствующие заболевания объясняют разнообразие не полностью. Исследовательские группы по всему миру изучают генетические факторы, которые могли бы помочь прогнозировать развитие тяжелых и крайне тяжелых форм.
Докладчица и ее коллеги провели анализ полногеномных ассоциаций (GWAS), чтобы выявить регионы, ответственные за более тяжелое течение, изучить молекулярные механизмы, которые могут связывать полиморфизмы в этих локусах с развитием инфекции и иммунного ответа, и построить полигенную шкалу риска тяжелого течения СOVID-19. На момент инициации исследования подобных исследований в российской популяции не проводилось.
Исследователи разделили 5629 взрослых пациентов из 52 регионов РФ на две группы: болевших без симптомов либо со слабыми и умеренными симптомами и тех, у кого болезнь протекала тяжело или крайне тяжело. Введя поправки на ИМТ и другие факторы, обнаружили 121 потенциально значимый вариант. Варианты с наибольшей значимостью находились в одном регионе хромосомы 6, в генах CCR9, FYCO1, LZTFL1, XCR1, TMLHE-AS1, SCYL2. Некоторые из этих генов ранее были связаны с тяжелым течением COVID-19. Интересно, что данный локус 3p21.3 демонстрировал сильную связь с раком почки.
Важным источником фенотипических вариаций являются некодирующие SNP в энхансерных регионах. Авторы идентифицировали кандидатные энхансерные участки рядом с интересующими генами; значимые варианты затронули энхансеры генов FYCO1 и LZTFL1. LZTFL1 ассоциирован с дифференцировкой клеток мерцательного эпителия бронхов, также участвует в Т-клеточном ответе. FYCO1 является основным стимулятором аутофагии, механизма антибактериальной и противовирусной защиты.
Авторы также выявили SNP в кодирующих участках, в том числе две несинонимичные замены в FYCO1. Фолдинг белка FYCO1, выполненный с помощью программы AlphaFold2, указывал на то, что замены ведут к более плотной упаковке и сниженной конформационной подвижности.
Механизмы аутофагии могут быть задействованы в жизненном цикле вируса. Авторы предположили, что ингибирование аутофагии может быть терапевтической опцией при COVID-19. В Италии было сделано наблюдение, что пациенты с лизосомными болезнями накопления не заражаются или редко заражаются COVID-19. В своей статье авторы обсуждают и другие возможные механизмы
Построенная авторами полигенная шкала рисков позволяет прогнозировать тяжесть течения COVID-19 с точностью до 95%.
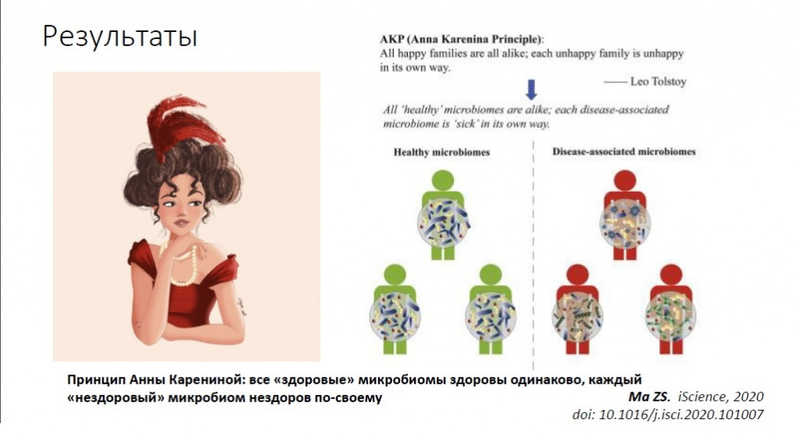
Доклад Ольги Игнатьевой (ЦСП ФМБА России) назывался «Динамика состава микробиома верхних дыхательных путей у пациентов с СOVID-19 и принцип Анны Карениной: все ли микробные “семьи” “несчастны” по-своему?»
Влияние состава микробиома верхних дыхательных путей (и других микробиомов, например, ЖКТ) на течение инфекции, активно исследовались во время пандемии. Ольга Игнатьева и ее коллеги сравнили микробиоту ВДП у 285 человек, инфицированных SARS-CoV-2, и ста здоровых людей. Пациентов исследовали в нескольких временных точках, начиная от поступления в стационар, чтобы изучить динамику состава микробных сообществ в процессе лечения. Важно включение в анализ ковариат, подчеркнула докладчица: состав микробиома зависит от пола, возраста, приема антибиотиков, и это также учитывалось.
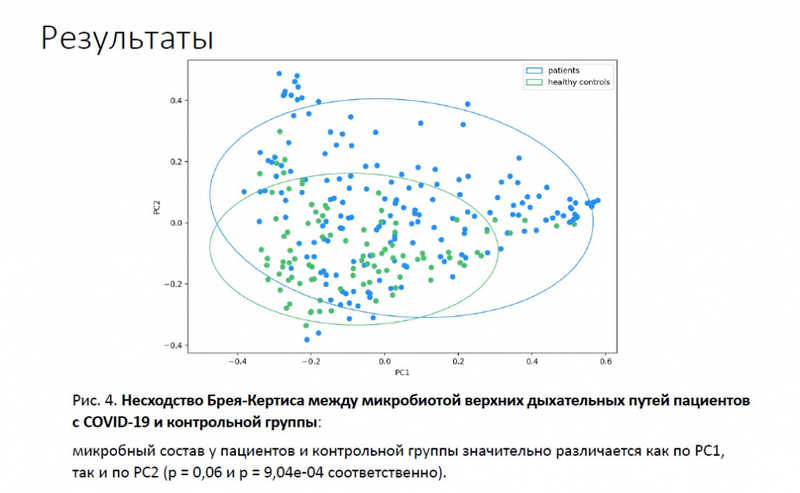
Видовой состав определяли с помощью метагеномного секвенирования (гены 16S р РНК). У пациентов также оценивали вирусную нагрузку с помощью цифровой капельной ПЦР. Были идентифицированы 86 родов микроорганизмов в обеих группах, в том числе 2 рода, уникальных для контроля, и 47 родов, уникальных для больных. Иными словами, микробиом пациентов разнообразнее? Однако индекс Шеннона был выше у здоровых, а у легких больных — выше, чем у тяжелых. Что касается бета-разнообразия (отношение разнообразия в конкретном местообитании к общему разнообразию) — в группе больных (синие точки на схеме) была выше дисперсия, они сильнее отличались друг от друга, чем здоровые (зеленые точки).
В целом коронавирусная инфекция сопровождается появлением большого количества новых странных таксонов в микробиоме ВДП и нарастанием дисперсии. Микробиомы пациентов утрачивают стабильность и становятся «патологически» разнообразными. Чжаншан Ма, китайский исследователь, аффилиированый в Университете Орегона, называет это «принципом Анны Карениной»: при стрессовых факторах «все микробиомы несчастны по-своему», происходят плохо предсказуемые, стохастические изменения, у каждого свои. По мнению докладчицы, это очень точно описывает происходящее с «ковидным» микробиомом верхних дыхательных путей.
У пациентов была снижена представленность 16 таксонов, в том числе родов Neisseria, Haemophilus и Pseudomonas. Снижение Neisseria и Haemophilus при ковиде отмечалось и в других работах. В процессе лечения микробиом изменялся в сторону нормы. Ко второй неделе наблюдалось снижение количества таксонов, а на протяжение второй недели оно опять росло, в первую очередь за счет родов Neisseria и Haemophilus; они могут служить маркерами выздоровления.
Вопрос о причинности — влияют ли вызванные вирусом воспаление, изменение слизистой на бактерии, или бактерии обуславливают течение болезни — пока остается нерешенным, отметила докладчица.
О пониженной чувствительности вирусов гриппа к препаратам специфического действия рассказала Наталья Бреслав (НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России). С падением заболеваемости COVID-19 увеличилось число случаев гриппа, но, к счастью, COVID-19 не повлиял на появление у вируса гриппа новых мутаций устойчивости.
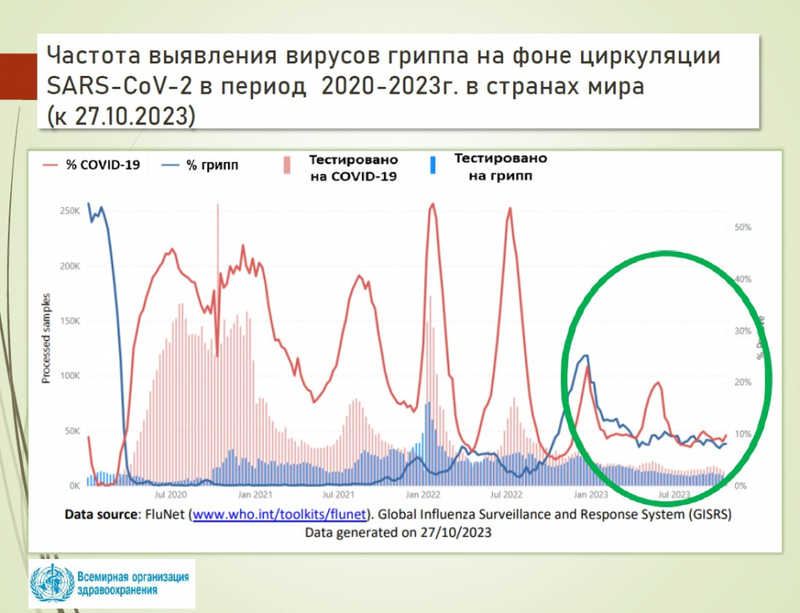
Докладчица напомнила, что к специфическим препаратам против гриппа относятся лекарства с прямым противовирусным действием и вакцины. (К неспецифическим — интерфероны, индукторы интерферонов, немедикаментозные средства и т.п.)
Ингибиторы нейраминидазы, останавливающие репликацию вируса (осельтамивир, занамивир, перамивир, ланинамивир; последние два еще не разрешены в РФ) — препараты выбора в настоящее время. По результатам докладчицы и ее коллег, профиль чувствительности к осельтамивиру и занамивиру в РФ остается благоприятным (в Чебоксарах нашли штамм со сниженной чувствительностью к обоим препаратам у пациента с пневмонией, но это не была полная резистентность). Ланинамивир — относительно недавняя японская разработка, препарат пролонгированного действия, применяется ингаляционно в виде одной терапевтической дозы. Ингибиторы нейраминидазы эффективны против самых разных эпидемических штаммов.
Адамантаны (амантадин, римантадин), угнетающие функцию протонного канала М2 вириона и предотвращающие миграцию вирусной РНК в ядро, более не используются как раз из-за повсеместно распространенной устойчивости к ним, в том числе среди высокопатогенных штаммов. (Но, возможно, синтетические структурные аналоги римантадина преодолеют эту проблему.)
Препарат, первый в своем классе, — ингибитор вирусной эндонуклеазы балаксовира марбоксил (Ксофлюза), появился недавно и применяется не очень широко, соответственно, крайне редко встречается устойчивость, однако в Японии она растет (4,5%). Фавипиравир одобрен для лечения гриппа только в Японии (в РФ включен в рекомендации по лечению ковида); пимодивир разработан в США и проходит фазу 3 клинических исследований.
Ингибиторы нейраминизады имитируют структуру натуральных субстратов фермента, которые связываются с ее каталитическим сайтом. Поэтому устойчивость может быть связана с мутациями в этом сайте (аминокислоты 119–294). Возникновение резистентности — обратная сторона высокой специфичности, подчеркнула докладчица; чем выше специфичность препарата, тем легче «ускользнуть» от его действия. С другой стороны, перекрестная резистентность (к нескольким ингибиторам нейраминидазы в результате одной мутации) возникает редко, это дает возможность подобрать эффективный препарат против любого штамма.
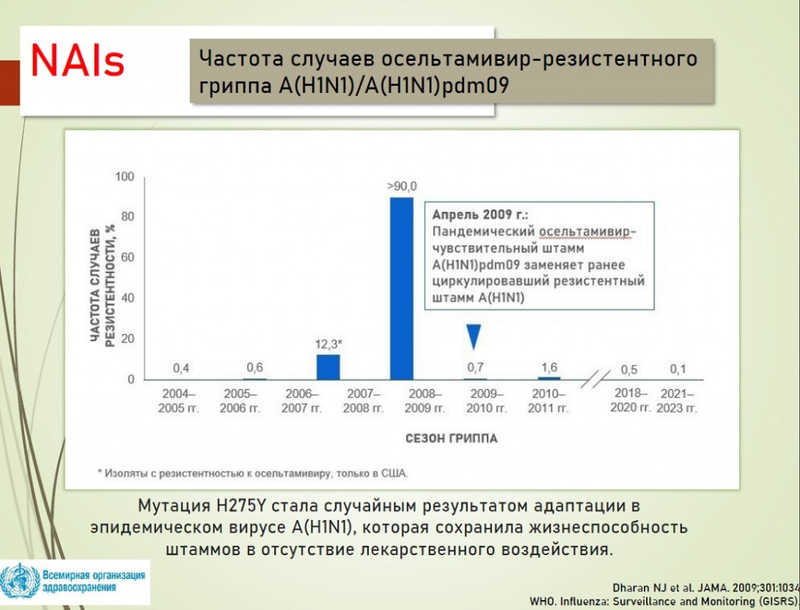
В качестве примера того, как легко может возникнуть устойчивость, Наталья Бреслав показала диаграмму с частотами случаев резистентности к осельтамивиру в разные сезоны; доля устойчивых случаев превысила 90% в сезон 2008–2009 года, когда распространилась мутация H275Y. Важно, что эта мутация сохранялась в отсутствие лекарственного воздействия. А вот пандемический вирус «свиного гриппа» A(H1N1)pdm09 резистентным не был, но вытеснил устойчивые штаммы за счет других свойств, и после этого проблемы с резистентностью возникали гораздо реже.
Докладчица также рассказала об Арбидоле (умифеновире), «оригинальном российском препарате с международной известностью». Вокруг механизма его действия много споров, отметила она; предполагается, что он взаимодействует с гемагглютинином и ингибирует цикл вирусной репродукции, и это «немного не прямое действие, а опосредованное». Она сообщила, что препарат используется в России уже много лет, а устойчивые к нему штаммы in vitro до сих пор не идентифицированы. Отвечая на вопрос из зала, Бреслав отметила, что обсуждает только эксперименты in vitro с арбидолом, и не оспаривает тот факт, что в клинических исследованиях эффективность препарата не показана.
Риск формирования резистентных штаммов предупреждается ранним назначением препаратов в адекватных дозах. Однако эксперты ВОЗ не рекомендуют применение ингибиторов нейраминидазы для профилактики гриппа: именно профилактическое назначение препаратов адамантанового ряда привело к распространению резистентности к ним.
Доклад Людмилы Николаевой (НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России) был посвящен влиянию генетического полиморфизма человека на течение инфекций.
«Грядет эра персонифицированной медицины, и готовиться к ней нужно уже сегодня», — сказал Джордж Черч в 2007 году. Прошло более 20 лет с момента публикации чернового варианта генома человека; теперь мы знаем, что у человека около 23 тысяч генов, в нашем геноме около 15 млн однонуклеотидных полиморфизмов (примерно 1 на 350 п.о.). Геном человека сложно организован (вспомним хотя бы гены, расположенные внутри интронов). Все больше мы узнаем о роли малых РНК, эпигеномных меток.
Гены предрасположенности, влияющие на течение инфекционных и неинфекционных заболеваний, обнаружены в системах детоксикации, гемостаза, эндотелиальной системе, в липидном обмене; но 50% таких генов вовлечены в работу иммунной системы. Первое звено защиты от инфекций — врожденный иммунитет: дендритные клетки, естественные киллеры, HLA и толл-подобные рецепторы, цитокины (интерфероны, интерлейкины, хемокины и другие биологические молекулы).
В дальнейшем докладчица сосредоточилась на интерферонах лямбда (интерфероны III типа). Они являются модуляторами иммунитета при инфекциях органов дыхания, ЖКТ, нервной системы, плаценты, причем не только регулируют мукозальный иммунитет, но и влияют на приобретенный иммунитет. Их рецепторы есть на дендритных клетках, моноцитах, нейтрофилах, они усиливают пролиферацию Т-хелперов 1 типа.
В отличие от интерферонов I типа, интерфероны лямбда снижают активность нейтрофилов и продукцию провоспалительных интерлейкинов и выработку активных форм кислорода. Они влияют на течение множества вирусных и бактериальных заболеваний, среди которых цитомегаловирусная инфекция, грипп, герпес, ВИЧ-инфекция и вирусные гепатиты, туберкулез, сальмонеллез. Частоты полиморфизмов, ассоциированных с генами интерферонов лямбда, сушественно различаются в разных регионах. Носительство тех или иных аллелей влияет, например, на течение гепатита С и вероятность элиминации вируса.
Выработка интерферонов лямбда — одно из ключевых событий, определяющих исход инфекции вирусом гриппа. При этом роль полиморфизма их генов применительно к гриппу изучена слабо, хотя есть интересные наблюдения: например, некоторые полиморфизмы влияют на сероконверсию при вакцинации от гриппа.
Секцию завершил доклад «Опыт использования ЛИС для автоматизации диагностики респираторных инфекций и оперативной отчетности») Елены Иптышевой («Мой медицинский центр», Санкт-Петербург). Докладчица высоко оценила лабораторную информационную систему компании «Акросс», которая помогла реорганизовать ковид-диагностику во время пандемии и подняла ее на новый уровень, а также тест-системы «Вектор-Бест».
Информация о докладчиках
Эйдельштейн Инна Александровна. НИИ антимикробной химиотерапии Смоленского государственного медицинского университета
Воронина Ольга Львовна. ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России;
Гусакова Мария Сергеевна, ЦСП ФМБА России.
Игнатьева Ольга Андреевна. ЦСП ФМБА России
Бреслав Наталья Владимировна. ФГБУ «НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Минздрава России
Николаева Людмила Ивановна. НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России
Иптышева Елена Петровна. «Мой медицинский центр» (Санкт-Петербург). Доклад подготовлен при поддержке компании «Акросс»


 Меню
Меню





 Все темы
Все темы




 0
0