МД-2023: Российские секвенаторы
В рамках конференции «Молекулярная диагностика 2023» 16 ноября прошла секция «Новейшие разработки в области массового параллельного секвенирования (NGS)». Российские докладчики рассказали о создании отечественных секвенаторов, а приглашенные гости — о наладке работы по секвенированию в отдаленных лабораториях Индии и о выявлении функций различных видов метилирования РНК на уровне единичных клеток.

Открыл секцию Олег Глотов, д.б.н., ФГБУ Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства (Санкт-Петербург) и ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии имени Д.О. Отта» (Санкт-Петербург), который выступил с докладом «Секвенирование экзома человека и перспективы предиктивной медицины».
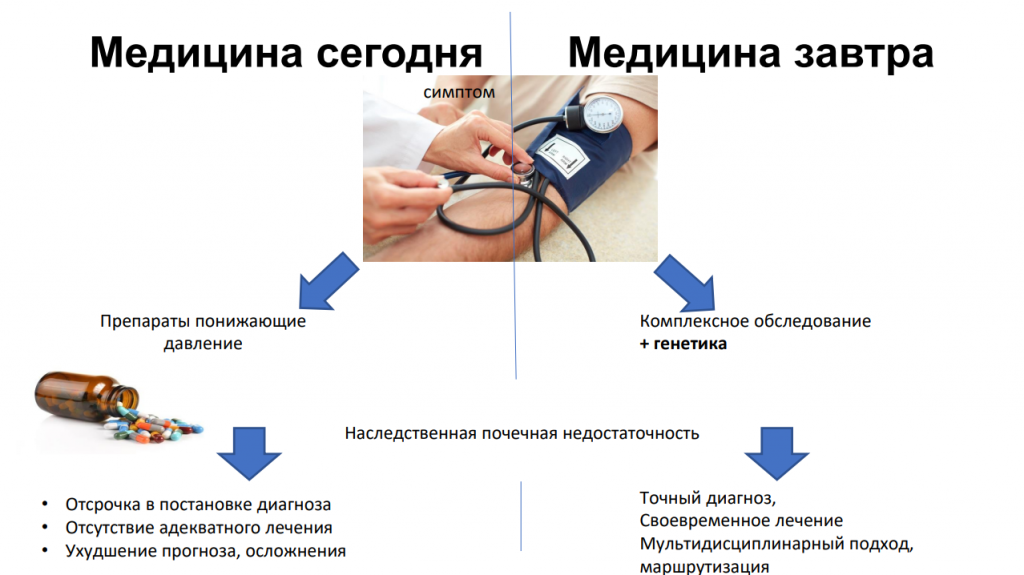
На сегодняшний момент медицина лечит симптомы. Например, у пациента наследственная почечная недостаточность. Ему просто назначают препараты, понижающие давление. В результате происходит отсрочка в постановке диагноза, ухудшение прогноза, осложнения и так далее. Если же исследовать генетические особенности и провести комплексное лечение, то это позволит поставить точный диагноз, назначить своевременное лечение, становится возможным мультидисциплинарный подход.
Основная задача медицинской генетики — интегрировать генетические знания в клиническое мышление врачей.
Концепция медицины постоянно развивается, от трех «П» (предиктивной, превентивной и персонализированной медицины) к точной экзомной медицине. Все это стало возможным с развитием технологий.
Докладчик заострил внимание на вопросе терминологии. Так, следует отказаться от термина «мутация», и не только в генетике человека. Вместо терминов «мутация» и «полиморфизм» предлагается использовать термин «вариант нуклеотидной последовательности» с пятью характеристиками: патогенный, вероятно патогенный, неопределенного клинического значения, вероятно доброкачественный, доброкачественный.
Генетический вариант — основной носитель предикции патогенности заболеваний с двумя основными характеристиками: пенетрантностью и экпрессивностью.
С генетической точки зрения выделяют моногенные, олигогенные, мультифакторные и приобретенные заболевания. Различия — вклад генетики и окружающей среды. Как это использовать? Экзомное секвенирование является наиболее удобным инструментом. Докладчик рассказал об эволюции понятия генетического паспорта.
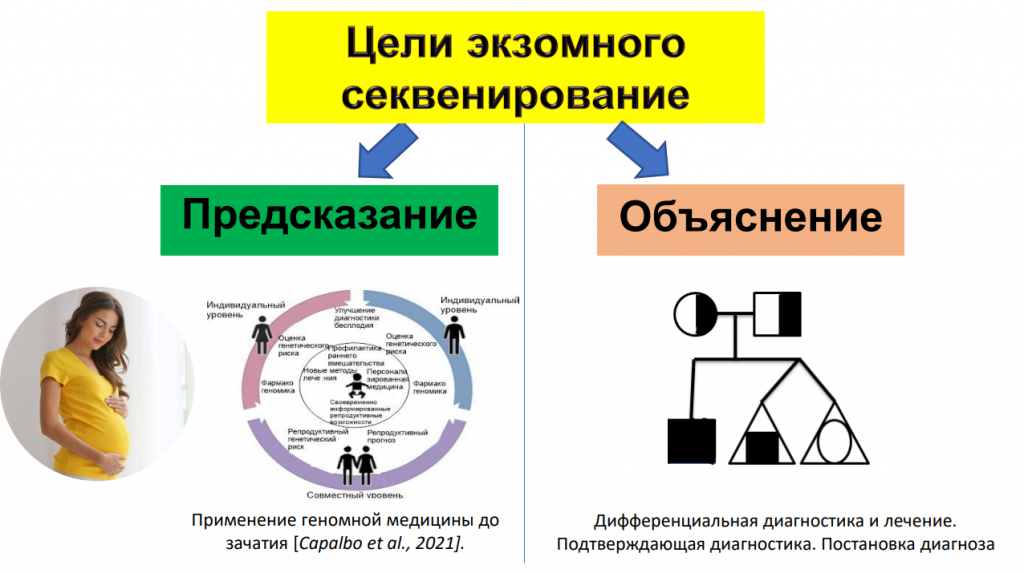
Цели экзомого секвенирования делятся на две части: предсказание рисков и объяснение структуры заболевания. Предсказание рисков очень важно для сохранения здоровья нации.
Чтобы выявить распространенность генетических вариантов, нужно проводить генетические исследования, определение генетической структуры человеческой популяции. Однако у нас геномных проектов было не так уж много. Для обмена генетической информацией была создана база данных RUSeq.
Докладчик рассказал, что его группа находила клинически значимые генетические варианты, которые должны были привести к развитию болезни, но болезни вроде не наблюдали. Однако анализ показал, что в семье были признаки болезни, и это позволяет предположить, что заболевание проявится в будущем.
Особенности результатов генетических тестов: новая семья — новый патогенный вариант, разные патогенные варианты в одном гене — различное течение заболевания, патогенный вариант в одном гене — различные заболевания, сочетание патогенных вариантов в разных генах. Все не так просто.
Олег Глотов привел примеры применения секвенирования для идентификации новых вариантов на примере диабета и гена MODY.
Нужно переходить к профилактике, к планированию семьи с использованием генетических технологий, приходить к преконцепционному скринингу.
С помощью экзомного секвенирования можно анализировать даже небольшие когорты. Благодаря многоуровневому подходу к анализу экзома в них можно идентифицировать генетические маркеры. Главное – применять рациональную фильтрацию и ранжирование потенциально значимых вариантов. Также докладчик рассказал о генетических исследованиях, связанных с коронавирусной инфекцией.
Ян Ин (Yang Ying), PhD, Beijing Institute of Genomics, Chinese Academy of Sciences (CAS), прочитала доклад на тему «Development of RNA Methylome Sequencing Techniques at Single-Cell Resolution».
Она подчеркнула роль эпигенетических нарушений в заболеваниях и старении. Основная область ее интересов — изучение роли метилирования РНК и вопрос его обратимости. Уже было идентифицировано более 170 типов метилирования РНК.
Исследователи развивают технологии для секвенирования и анализа, выявляют механизмы, в том числе ферменты, а также функции — физиологические и патологические процессы. Команда докладчицы показала динамическую обратимость и биологическое значение РНК-метилирования.
Она рассказала о роли m6A во время развития ооцита у мыши. Для выявления этой модификации в единичных клетках путем секвенирования был разработан метод scm6A-seq.
В ходе этой работы, в частности, было показано, что деплеция Mettl3 приводит к уменьшению размера яичника и блокировке созревания ооцитов. Уровень m6A сильно снижается в ооцитах с нокаутом Mettl3. Стабильность m6A-модифицированных транскриптов повышается в ооцитах с нокаутом Mettl3. То есть Mettl3 способствует деградации метилированных РНК в ооцитах. m6A способствует трансляции во время созревания ооцита. Экспрессия m6A-модифицированных РНК повышается во время перехода от ооцита к зиготе. Был получен атлас m6A-метилома во время раннего эмбриогенеза.
Для детекции модификации m5C в единичных клетках был разработан метод scRNA-BisSeq. За установку m5C на мРНК отвечает метилтрансфераза NSUN2. Были идентифицировали три фермента, способные прочесть эту модификацию (ALYREF, YBX1, YBX2), и установлена их роль в метаболизме. Была показана роль модификации при переходе от ооцита к зиготе, при раке мочевого пузыря и колите. Роль m5C изучали на ооцитах рыбок данио. Уровень метилирования РНК в этом сайте нарастал при переходе от ооцита к четырехклеточному эмбриоу.
Егор Прохорчук, д.б.н., профессор, чл.-корр. РАН, ФГУ ФИЦ «Фундаментальные основы биотехнологии» РАН (Москва), прочитал доклад на тему «О возможностях импортозамещения в области секвенирования ДНК». Он подчеркнул, что если начнется еще одна пандемия, мы окажемся абсолютно беззащитными в вопросе секвенирования, так как полностью зависим от зарубежного оборудования, сервиса, реактивов. После чего рассказал о попытках создания отечественного секвенатора.
Исследовательская группа докладчика попыталась воспроизвести технологию полупроводникового секвенирования. Технология состоит из трех частей: детектор, микрочип и микрочастицы, на которых происходит рост молекулярных колоний.
Детектор был выполнен в ООО «Геноаналитика», потом передали технологию в ООО «Полупроводниковые генетические технологии». Испытали с чипом 314 от ThermoFisher и с американскими реактивами. Было получено неплохое распределение по качеству чтения, риды длиной приблизительно 100.
Сделали электронные микрофотографии чипа, спектральные анализ. В начале следующего года собираются пробовать синтезировать чипы.
Мембрана с порами создает монодисперсную эмульсию размером 15 микрон, куда попадает один кремниевый шарик. Работа над этим элементом в процессе.
Очень сложно соединить все три компонента в одном приборе. Финансируется проект частной компанией, все это двигается достаточно медленно.
Докладчик предположил, что разработанные ими технологии можно соединить с технологиями «Синтола».
Он подчеркнул, что они пытаются сделать простой секвенатор. В первую очередь его бы можно было использовать для контроля эпидемиологической ситуации, определения вирусной и бактериальной нагрузки. Университеты могли бы купить секвенаторы еще до получения РУ. После получения РУ их могли бы приобрести онкодиспансеры, женские консультации, перинатальные центры. Докладчик оценил объем рынка.
Развитие рынка секвенирование в России тормозится по таким причинам, как отсутствие РУ на приборы и реактивы для медицинского применения, высокая стоимость секверирования и отсутствие достаточного количества квалифицированных технических кадров для заполнения мест в диагностических лабораториях в масштабах страны.
Раджа Мугасимангалам (Raja Mugasimangalam), PhD, Genotypic Technology Private Limited (India), выступил с докладом «Recent developments in Applying Genomics in the field, from hospitals to remote Labs in India». Он рассказал о своей компании — Genotypic Technology Private Limited, которая была организована в 1998 году. Миссию компании он обозначил как упрощение сложных геномных процессов и сближение биологии и технологий.
Докладчик описал вызовы, с которыми сталкиваются отдаленные лаборатории в Индии при начале работы с генетическими технологиями. В первую очередь это недостаток оборудования, у них может не быть даже центрифуг. У сотрудников нет опыта в секвенировании. Сложности в доставке реагентов и аксессуаров в отдаленные лаборатории. Есть еще проблема обработки полученных данных. По словам докладчика, сотрудники знают BLAST, но больше ничего. Не хватает высокопроизводительных компьютеров и поддержки.
Сотрудники лабораторий могут выделять нуклеиновые кислоты из образцов, они знают ПЦР. Но секвенирование — другое дело.
Более 50% лабораторий находятся в сельских районах. Это привносит свои проблемы.
В результате было выбрано нанопоровое секвенирование, в основном портативные MinIon.
Лаборатории используют очень простой протокол с пулом праймеров, разработанных Genotypic, вместо создания сложных библиотек. Потом идет секвенирование, которое занимает около 6 часов
Далее докладчик рассказал, как они решают проблему анализа данных, полученных при секвенировании, с помощью Commander и GPU.

Светлана Апалько, к.б.н, НИЛ трансляционной биомедицины и СПб ГБУЗ «Городская больница № 40», прочитала доклад «Разработка моделей для оценки полигенных рисков на основе данных секвенирования генома с низким покрытием»
Отличия людей друг от друга заложены в вариациях ДНК, которые представлены однонуклеотидными полиморфизмами. По количеству таких SNP выделяют полигенные признаки — это рост, цвет волос и глаз. Вопрос – как обобщить влияние такого количества полиморфизмов и определить с их помощью сам признак.
Есть разные методы, один из них — оценка полигенных рисков. Но сначала нужно знать, какие полиморфизмы отвечают за изучаемый признак. Для оценки ассоциации полиморфизма с признаком часто используют полногеномный поиск ассоциаций.
Если по оси Y расположить признак, а по оси X — генотип, то можно построить линейный регрессионный тест, а потом рассчитать эффект каждого полиморфизма на изучаемый признак. Такой расчёт проводится для каждого полиморфизма.
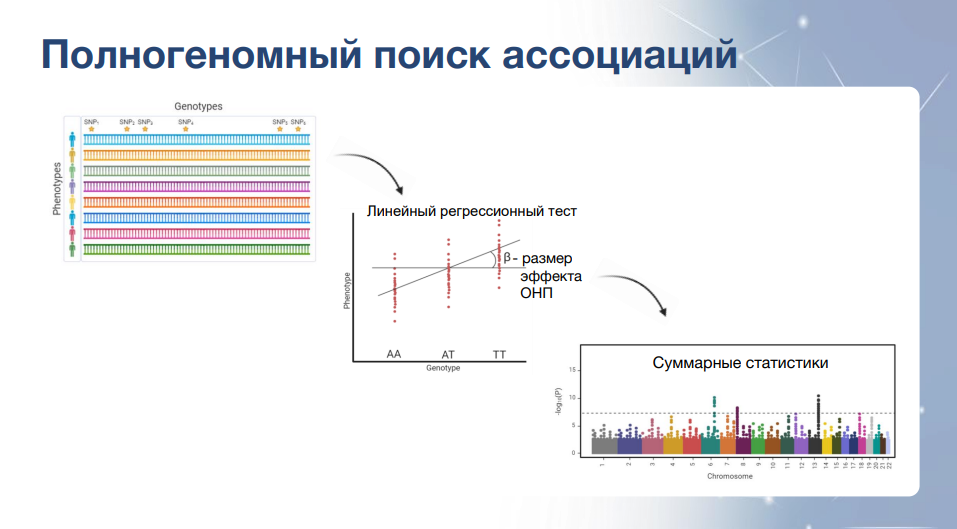
Строится суммарные статистики, которые отражают эффект каждого полиморфизма на признак. Бета – размер эффекта, выраженная числовым значением. Суммарные статистики, как правило, представляются в виде графика Манхэттен, где X — генетическая координата полиморфизма, а Y — их сила ассоциации с изучаемым признаком.
Зная генетические характеристики человека, можно вычислить полигенные риски. При этом, чтобы построить вектор генотипов, нужно перевести в числовые значения аллельные варианты всех полиморфизмов.
Полигенный риск — сумма ассоциированных полиморфизмов с признаком, взвешенная по размеру эффектов.
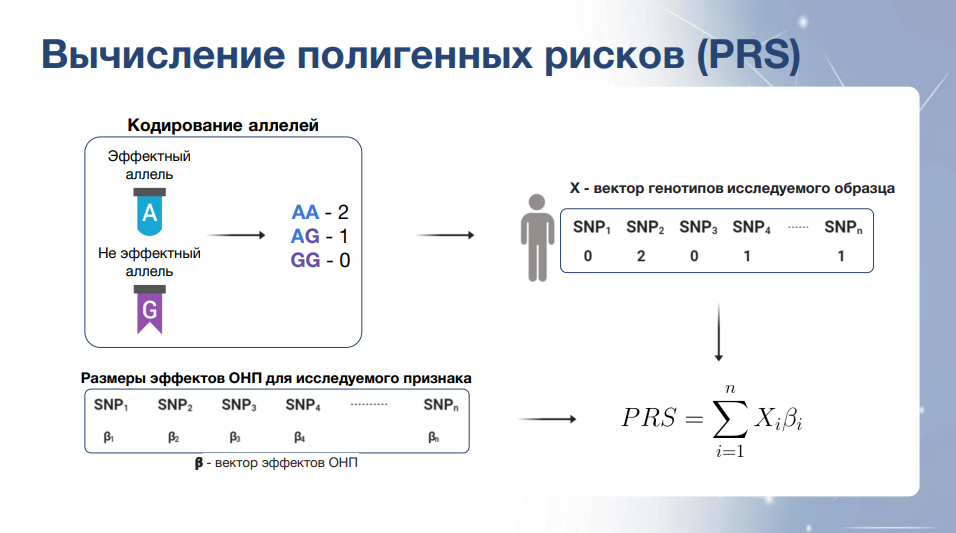
Однако в таком виде это использовать нельзя, чтобы корректно рассчитать полигенный риск, нужно построить модель полигенных рисков.
Полученные на тренировочной выборке суммарные статистики содержат значения ассоциации полиморфизмов без учета неравнозначного сцепления. Переоценка эффектов ОНП с учетом LD структуры как раз и ведет к получению модели полигенных рисков. И после ее построения уже можно рассчитывать полигенные риски для исследуемой выборки.
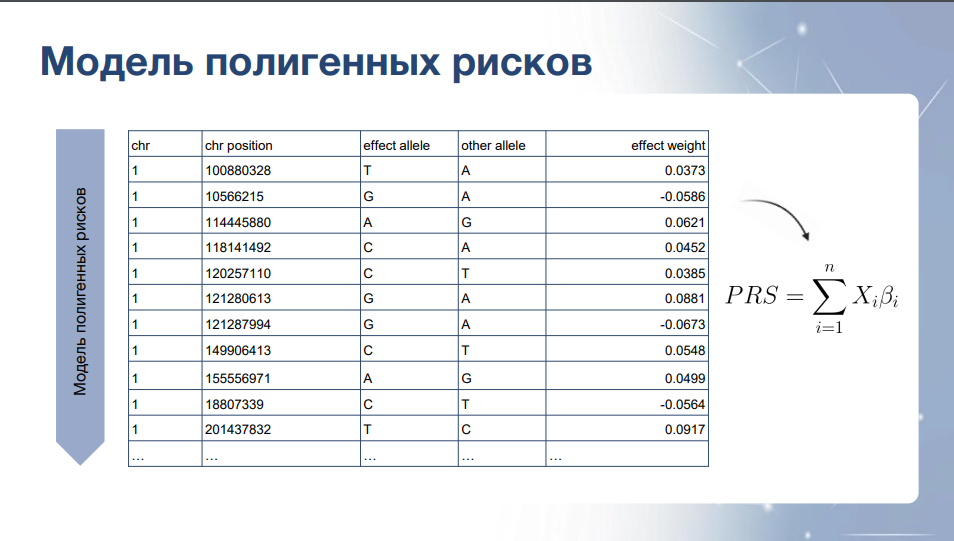
Как интерпретировать модель полигенных рисков? Есть два метода. Первый — вычислить абсолютное значение признака, второй — относительная интерпретация. Во втором случае, зная генетику исследуемой популяции и изучаемый признак, строится модель полигенных рисков и распределение этих полигенных рисков (низкий, средний, высокий риск). Такую модель можно построить для любого признака. Интерпретация в таком случае — в процентилях.
Получить много данных можно с помощью секвенирования с низким покрытием. Ранее использовались микрочипы. Для построения полигенных рисков необходимы большие выборки, поэтому невозможно использовать секвенирование со стандартным покрытием, но оно и не нужно.
Один из биоинформатических алгоритмов достроения пропущенных вариантов — это импутация, которая позволяет достроить пропущенные варианты с 99%-ной точностью.
В последнее время масштабные генетические исследования на образцах европейских биоколлекций, то есть данные отражают европейские популяции. Такие данные транслировать на неевропейские популяции, в том числе российские, невозможно.
Нужно калибровать данные, полученные на европейских популяциях, для российской популяции
Нужны данные для нашей популяции. Для этого существует биобанк.
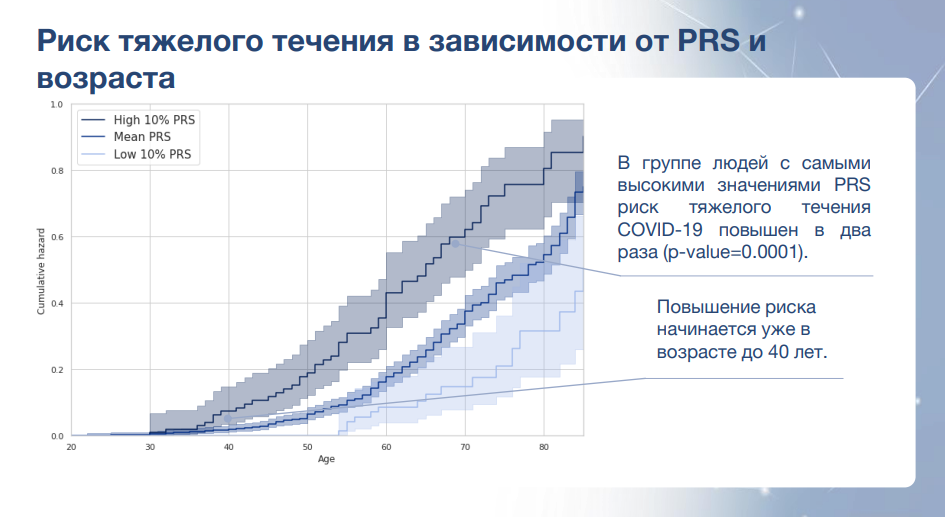
Докладчица рассказала об их биобанке , где основную часть занимают образцы, полученные во время пандемии. Один из проектов — оценка полигенных рисков тяжелого течения COVID-19.
В исследование вошли 1085 человек. Из них выделили опытную группу (с поражением легких более 50%) и контрольную группу (не болевшие и с поражением легких менее 50%).
В каждом запуске использовали один и тот же контрольный образец ДНК.
Среднее значение PRS в опытной группе выше, чем в контрольной группе. В группе людей с самыми высокими значениями PRS риск тяжелого течения COVID-19 повышен в два раза ( в раннем возрасте).
Яков Алексеев из компании «Синтол» прочитал доклад «Современные отечественные разработки в области массового параллельного секвенирования». Он отметил высокие темпы развития генетических технологий.
Российский рынок сейчас активно насыщается китайскими технологическими решениями. Но классические секвенаторы из Китая стоимостью 22 тыс. долларов США предлагаются и продаются в России по 150 тыс. долларов США.
В настоящее время серьезные разработки создаются не в одиночку. В консорциум «Российские генетические технологии» входят Институт аналитического приборостроения РАН (разработка новых приборов), АО ЭЗАН (серийное производство), «НПФ Синтол» (реагенты, маркетинг, продажи, пусконаладка приборов и обучение пользователей), а также другие компании.
В этом году компания «Синтол» приблизилась к отметке 100 приборов «Нанофор 05» в год. Это дает надежду, что и серийное производство полногеномных секвенаторов тоже возможно в довольно больших масштабах.
«Синтол» производит прибор «Нанофор СПС» — полногеномный секвенатор, аналогичный MiSeq от Illumina. Он разрабатывался для анализа небольших геномов, например, бактерий и вирусов, или таргетного секвенирования.
ОКР успешно завершена в 2020 году, но только в апреле этого года было получено разрешение на производство. Был заключен лицензионный договор с Минздравом РФ. В этом году выпущена установочная серия из трех приборов.
Компания «Синтол» в настоящее время разработала собственный софт для анализа образов и распознавания кластеров на поверхности ячейки. Все реагенты, входящие в состав картриджа, — сложные отечественные смеси.
В настоящее время сделано уже более 100 запусков опытных образцов. Компания приступила к серийному производству, которые будут поставлены в НИЦ Курчатовский институт, НМИЦ Онкологии им. Н.Н. Петрова и ФИЦ ИМБЮМ им. А.О. Ковалевского.
В конце 2024 — начале 2025 года планируется запуск более крупной серии. Стоимость приборов докладчик назвал «комфортной» по сравнению с китайскими аналогами. Интерес к ним есть.
Тамара Симакова, к.б.н., PARSEQ LAB LLC, прочитала доклад «OncoScope NSCLC — комплексное NGS-решение для исследований в онкологии» о пилотном применении тест-системы OncoScope NSCLC, которая разработана для тестирования генов, ассоциированных с немелкоклеточным раком легких.
Маркеры — стандартные для немелкоклеточного рака легких. ДНК-овая часть системы включает основные онкогены и позволяет выявлять точечные мутации. РНК-овая часть позволяет выявлять фьюжены онкогенов и генов-партнеров (в том числе неизвестных), а также пропуски экзонов.
Протокол простой, двухстадийный. На первом проходит таргетная ПЦР с праймерами, которые уже содержат в себе адаптеры. Потом — индексирующая ПЦР и суммирование. Библиотеки готовы для секвенирования.
Программа сама разбирает ДНК-овые и РНК-овые прочтения, автоматически выполняется контроль качества, пайплайн также позволяет идентифицировать фьюжены с неизвестными партнерами.
Пайплайн — биоинформатический инструмент, поэтому требуется еще программное обеспечение, пользовательский интерес. Он также входит в состав этого решения, как и реагенты
Система была выпущена в январе, она уже тестируется почти год, так что в нее были внесены улучшения, такие как совместимость с платформой GeneMind. Пока аналитические характеристики установлены для платформы Illumina.
Верификация системы проводилась на международных референсных материалах. Аналитические характеристики представлены на слайде.

Также докладчица рассказала о трудностях, с которыми пришлось столкнуться при апробации, и о том, как их удалось преодолеть. В результате апробации была добавлена пользовательская аннотация вариантов и автоматическая реаннотация, возможность обмена аннотациями между пользователями, импорта хотспотов и другие возможности.
На третий квартал 2024 года планируется получение РУ.
Татьяна Родионова из компании «Квадрос-Био» (Москва) выступила с докладом «Обеспечение работы NGS-лаборатории в условиях санкционных ограничений»
«Квадрос-Био» — российская компания-дистрибьютор лабораторного оборудования и расходных материалов с более чем 10-летним опытом. Специализация — научное оборудование и реагентика для биобанкинга, молекулярной генетики и клеточных технологий.
До выделения НК зачастую образец нужно разрушить. Иногда это нетривиальная задача. Докладчица представила роторный гомогенизатор образцов GeneReady BSH-CL2P. Он может охлаждать образцы и инактивировать опасные образцы.
Для очистки НК предлагается автоматизированная платформа iCatcher, которая эффективно удаляет ингибиторы и загрязнения.
Предлагаются наборы для экстракции ДНК, РНК, цНК из разных образцов и система капиллярного электрофореза Qsep от BiOptic. Картриджная система — капилляр и емкость с полимером заключены в футляр, 100-300 запусков на картридж. Очень хорошо подходит для оценки качества библиотеки перед NGS.
Для фрагментации образца предлагается ультрасоникатор фокусированного действия Longlight BoFU. В нем образец не перегревается. Для цифровой ПЦР есть прибор Sniper DQ24, который докладчица назвала «жемчужиной».
Докладчица предложила желающим пройти на стенд компании и посмотреть на приборы.
Информация о докладчиках
Олег Сергеевич Глотов, д.б.н., ФГБУ Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства (Санкт-Петербург) и ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии имени Д.О. Отта» (Санкт-Петербург)
Yang Ying, PhD, Beijing Institute of Genomics, Chinese Academy of Sciences (CAS)
Егор Борисович Прохорчук, д.б.н., профессор, чл.-корр. РАН, ФГУ ФИЦ «Фундаментальные основы биотехнологии» РАН (Москва)
Raja Mugasimangalam, PhD, Genotypic Technology Private Limited (India)
Светлана Вячеславовна Апалько, к.б.н, НИЛ трансляционной биомедицины и СПб ГБУЗ «Городская больница № 40»
Яков Игоревич Алексеев, к.б.н., «СИНТОЛ»
Тамара Сергеевна Симакова, к.б.н., PARSEQ LAB LLC
Татьяна Викторовна Родионова, «Квадрос-Био» (Москва)


 Меню
Меню





 Все темы
Все темы




 0
0