Метаболит кишечной микробиоты повышает риск лейкемии у пожилых людей с клональным гемопоэзом
Исследователи из Великобритании и США показали, что нарушение барьерной функции кишечника, связанное со старением и воспалительными заболеваниями, ведет к росту в крови уровня микробного метаболита — АДФ-D-глицеро-β-D-манногептозы (АДФ-гептозы). Это промежуточное соединение синтеза липополисахаридов, специфичное для грамотрицательных бактерий. АДФ-гептоза связывает рецептор ALPK1 в мутантных прелейкемических гемопоэтических клетках, которые накапливаются в организме людей с клональным гемопоэзом, и стимулирует их экспансию. Под действием АДФ-гептозы клональный гемопоэз может перерасти в лейкемию.
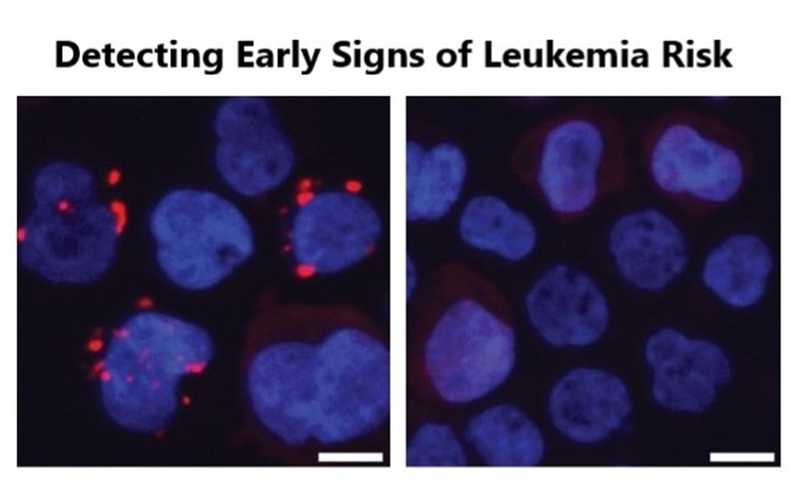
TIFAсомы (красные) образуются в клетках крови при культивировании с плазмой пожилого здорового 73-летнего человека (слева), но не при культивировании с плазмой молодого здорового человека 31 года (справа).
Credit:
Cincinnati Children's | Пресс-релиз
Клональный гемопоэз неопределенного потенциала (КГНП) — ассоциированное со старением состояние, при котором происходит экспансия мутантных прелейкемических гемопоэтических клеток. КГНП повышает риски развития лейкемии и иммунных заболеваний. Факторы, способствующие его развитию, не до конца ясны. Исследователи из Великобритании и США продемонстрировали роль микробиоты кишечника в экспансии прелейкемических клеток. В частности, АДФ-D-глицеро-β-D-манногептоза (АДФ-гептоза), побочный продукт, специфичный для грамотрицательных бактерий, встречается в крови пожилых людей и способствует пролиферации прелейкемических клеток.
КГНП ассоциирован в первую очередь с мутациями в генах эпигенетических модификаторов DNMT3A, TET2 и ASXL1 в гемопоэтических стволовых клетках, которые приводят к появлению прелейкемических клеток. КГНП, связанный с мутациями в DNMT3A, повышает риск развития миелоидной опухоли в четыре раза, однако факторы, способствующие распространению DNMT3A-мутантных клеток, неизвестны. Недавние исследования показали, что инактивирующие мутации в DNMT3A чаще встречаются у людей старшего возраста и с хроническими воспалительными заболеваниями кишечника. Поэтому авторы оценили роль нарушения барьерной функции кишечника в экспансии прелейкемических клеток с мутациями в DNMT3A.
На мышей воздействовали радиацией, которая или повреждала эпителиальный барьер кишечника (8 Гр), или нет (2,5 Гр), а затем пересаживали им Dnmt3a−/− клетки костного мозга. У мышей, облученных высокой дозой радиации, трансплантация привела к экспансии мутантных гемопоэтических стволовых клеток и повышению уровня химеризма периферической крови. При низкой дозе радиации такого не происходило.
Затем мышам, на которых воздействовали низкой дозой радиации, пересаживали Dnmt3a−/− клетки костного мозга и давали им декстран сульфат натрия (повреждает эпителий кишечника). У них тоже повышалось количество гемопоэтических стволовых клеток Dnmt3a−/−. Того же эффекта можно было добиться, пересаживая мутантные клетки старым мышам под действием низкой дозы радиации, а также при трансплантации микробиоты от старых мышей. Экспансия нивелировалась антибиотиками широкого спектра действия.
Дисфункция эпителия кишечника, которая часто встречается у людей пожилого возраста, приводит к дисбактериозу и распространению микробных побочных продуктов. Анализ показал, что количество бактериальной 16S рРНК повышалось в периферической крови мышей, получавших декстран сульфат натрия, а также у старых мышей по сравнению с молодыми. Особенно заметно повышалась доля грамотрицательных бактерий. То же было показано у людей пожилого возраста по сравнению с молодыми здоровыми контролями, а также у молодых людей с воспалительными заболеваниями кишечника. Однако не было выявлено конкретного вида бактерий, ассоциированного с этими состояниями. Антибиотики, таргетирующие грамотрицательные бактерии, предотвращали экспансию гемопоэтических стволовых клеток Dnmt3a−/−, а таргетирующие грамположительные бактерии — нет. Авторы предположили, что нарушение барьерной функции кишечника и дисбиоз провоцируют экспансию прелейкемических клеток.
Грамотрицательные клетки вырабатывают липополисахариды с различной иммуногенностью, но еще они вырабатывают АДФ-гептозу, очень иммуногенное растворимое промежуточное соединение пути биосинтеза липополисахаридов. АДФ-гептоза легко пересекает клеточную мембрану и взаимодействует с рецептором ALPK1 в цитозоле. После нарушения барьерной функции кишечника уровень АДФ-гептозы в крови мышей повышается, что показали методом масс-спектрометрии. Это соединение определяется у людей старшего возраста и у людей с миелодиспластическим синдромом или воспалительными заболеваниями кишечника, но не у молодых здоровых людей.
Исследователи облучили мышей низкой дозой радиации, пересадили им Dnmt3a−/− клетки костного мозга, а затем ввели им АДФ-гептозу. У мышей была показана экспансия гемопоэтических стволовых клеток Dnmt3a−/−. При пересадке клеток дикого типа такого эффекта не наблюдалось. Более того, экспансии также подвергались мышиные клетки Tet2−/− и Dnmt3aR878H/+ и прелейкемические клетки человека.
АДФ-гептоза связывает ALPK1 и активирует белок TIFA, формируя TIFAсомы и индуцируя активацию NF-κB. Уровни АДФ-гептозы и формирование TIFAсом ассоциировано с гипертензией и тромбоэмболизмом вен у людей с КГНП. Того уровня АДФ-гептозы, что циркулирует в крови людей с КГНП или с миелодиспластическим синдромом, было достаточно для появления TIFAсом и активации NF-κB в прелейкемических клетках.
В мутантных гемопоэтических стволовых клетках активируется экспрессия ALPK1, что позволяет им воспринимать АДФ-гептозу. Присутствие ALPK1 было необходимо, чтобы вызвать экспансию мутантных клеток. АДФ-гептоза изменяла транскриптом прелейкемических клетках и давала тем преимущество при пролиферации. По мнению авторов, на взаимодействие АДФ-гептозы и ALPK1 можно воздействовать, чтобы предотвратить прогрессирование КГНП в лейкемию и другие заболевания.
Клональная эволюция клеток хронического миелоидного лейкоза происходит быстрее, чем считалось
Источник:
Puneet Agarwal, et al. Microbial metabolite drives ageing-related clonal haematopoiesis via ALPK1 // Nature (2025), published 23 April 2025, DOI: 10.1038/s41586-025-08938-8


 Меню
Меню





 Все темы
Все темы




 0
0







