Мутации в белке RAS способствуют подавлению активности онкосупрессора DLC1
Выявлен новый механизм онкогенной активности мутантных белков RAS, независимый от канонических путей RAS-сигналинга, таких как PI3K/AKT и RAF/MEK. Этот путь регулирует экспорт ядерных белков в цитоплазму. В частности, мутантный RAS повышает в цитоплазме уровень белка EZH2, который способствует деградации белка-супрессора опухоли DLC1. Это открытие позволит повысить эффективность терапии ингибиторами RAS.
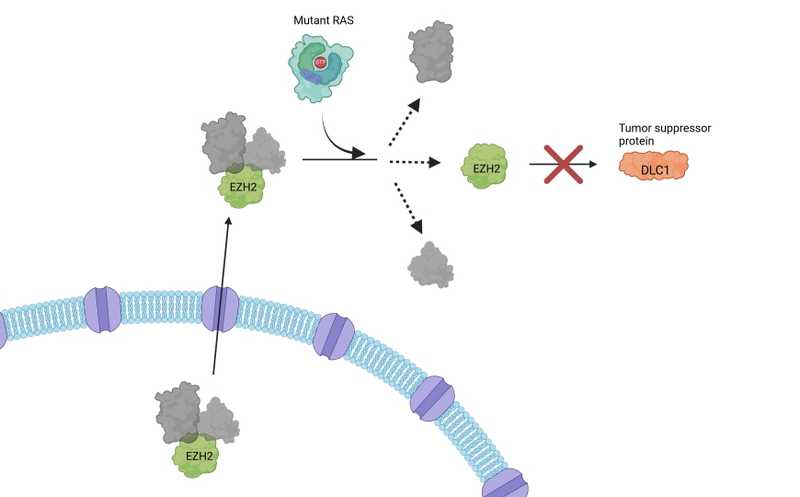
Мутантный RAS помогает высвобождению белка EZH2 из комплекса, транспортируемого из ядра в цитоплазму. EZH2 способствует распаду белка-супрессора опухолей DLC1, что приводит к неконтролируемому росту опухоли.
Credit:
Linda Wang | Пресс-релиз
Исследователи из Национального института рака (Национальные институты здравоохранения, США) совместно с коллегами из других научных центров выявили новый механизм онкогенной активности мутантных RAS-белков. Эти результаты могут привести к созданию инновационных терапевтических подходов для лечения рака, вызванного мутациями в генах RAS. Мутации данного типа ответственны за большинство случаев рака поджелудочной железы, половину случаев колоректального рака и треть случаев рака легких. Однако существующие препараты, блокирующие активность мутантных RAS, у большинства пациентов демонстрируют лишь временную эффективность.
Ранее было показано, что мутантные белки RAS активируют определенные белки, создавая постоянные сигналы роста и пролиферации. Их основные эффекторы — члены семейств RAF и PI3K, которые активируют пути MEK/ERK и AKT/mTOR соответственно. Авторы новой статьи, опубликованной в журнале Nature Cancer, показали, что некоторые эффекты мутантных RAS-белков не зависят от этих сигнальных путей. Они исследовали белок KRAS, принадлежащий к семейству RAS, и установили, что он способствует транспорту специфических белков из ядра и это приводит к неконтролируемому росту опухолей. Интересно, что руководитель данной работы Дуглас Лоуи, заместитель директора Национального института рака, участвовал в исследованиях конца 1980-х годов, в которых впервые были выявлены онкогенные свойства RAS.
Ученые идентифицировали новый белковый комплекс — RAS–RanGAP1, который влияет на работу экспортина 1 (XPO1). Как ясно из названия, этот белок опосредует экспорт белков и РНК из ядра. RAS взаимодействует с молекулой ГТФ и затем с белком Ran-ГТФазой 1 (RanGAP1). Этот комплекс, в свою очередь, облегчает высвобождение в цитоплазму белков, доставляемых XPO1.
Авторы исследовали влияние активности KRAS на транспорт белка EZH2, который, попадая в цитоплазму, уменьшает стабильность белка-онкосупрессора DLC1 и таким образом способствует прогрессированию рака. Когда экспрессию KRAS в культуре клеток снизили с помощью РНК-интерференции, в цитоплазме уменьшилось количество EZH2, а количество DLC1 выросло. Снизился и уровень цитоплазматического сурвивина, ингибитора апоптоза, экспорт которого из ядра также зависит от XPO1. При одновременном ингибировании XPO1 и KRAS не наблюдалось значительного повышения уровня DLC1 по сравнению с ингибированием каждого из них, и это подтверждало, что XPO1 и KRAS могут функционировать на разных этапах одного пути. Действительно, подавление активности KRAS не предотвращало образование комплекса XPO1 и EZH2, но предотвращало высвобождение EZH2 после его транспортировки из ядра в цитоплазму.
Кроме того, авторы подтвердили, что открытый ими путь не зависит не зависит от сигналов MAPK и PI3K, и обнаружили комплексы RAS-RanGAP1 во многих типах опухолевых и неопухолевых клеток. Они предполагают, что этот механизм может быть универсальным для различных типов рака с мутациями RAS.
Таким образом, неканоническая онкогенная функция RAS оказалась связанной с экспортом белков из ядра и подавлением функции онкосупрессора. Воздействие на определенные мишени, которое сохранило бы супрессорную активность DLC1, может быть перспективным терапевтическим подходом. Ранее авторы показали, что ингибирования EZH2 для этого недостаточно, поскольку активность DLC1 также подавляют киназы SRC и AKT. Ингибиторы этих киназ в комбинации с RAS-ингибиторами гораздо эффективнее восстанавливают функции DLC1 при раке, вызванном мутациями KRAS. Это подтвердилось как на клеточных линиях, так и на мышиной модели рака легких. Авторы предполагают, что можно использовать только ингибиторы SRC и RAS, так как последний снизит активацию АКТ.
«Это первое исследование, демонстрирующее, что мутантные RAS-гены могут вызывать рак по совершенно новому пути», — отметил Дуглас Лоуи. На данный момент исследователи изучают эту функцию RAS в контексте рака поджелудочной железы, для которого существует крайне мало эффективных методов лечения.
Ингибитор активной формы мутантного KRAS эффективен против рака легких у мышей
Источник
Tripathi, B.K., et al. The pro-oncogenic noncanonical activity of a RAS•GTP:RanGAP1 complex facilitates nuclear protein export // Nature Cancer (2024). DOI: 10.1038/s43018-024-00847-5
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








