Новая терапия алкоголизма у мышей позволяет избежать побочных эффектов
Американские ученые вылечили алкогольную зависимость у мышей с помощью препарата RapaLink1, ингибитора протеинкиназного комплекса mTORС1 в головном мозге. Второй препарат, RapaBlock, ингибирует RapaLink1 везде, кроме мозга, что позволяет избежать нарушений метаболизма и повреждений печени.

Ученые из Калифорнийского университета в Сан-Франциско разработали терапию для лечения алкоголизма. Эффективность продемонстрировали на мышах, при этом большинства побочных явлений удалось избежать. Терапия направлена на специфическое ингибирование белкового комплекса mTORC1 в головном мозге и состоит из двух препаратов — RapaLink1, ингибитора mTOR, и RapaBlock, ингибитора RapaLink1.
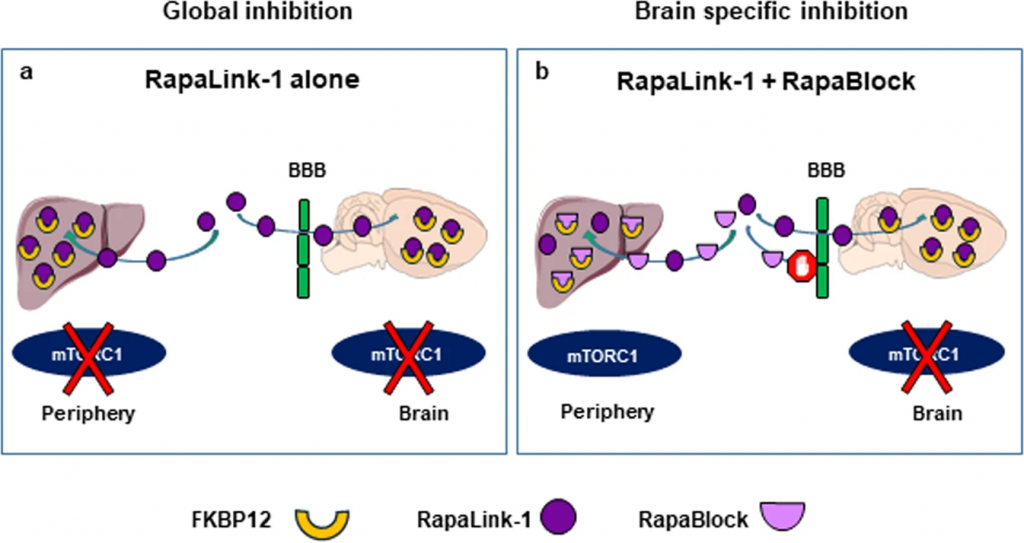 Изображение: Схема ингибирования mTORС1 с помощью RapaLink1 (слева) и комбинацией RapaLink и RapaBlock (справа). В первом случае mTORC1 подавляется во всем организме, во втором — только в мозге. Credit: Yann Ehinger, et al. DOI:
10.1038/s41467-021-24567-x
Изображение: Схема ингибирования mTORС1 с помощью RapaLink1 (слева) и комбинацией RapaLink и RapaBlock (справа). В первом случае mTORC1 подавляется во всем организме, во втором — только в мозге. Credit: Yann Ehinger, et al. DOI:
10.1038/s41467-021-24567-xmTORC1 (mammalian target of rapamycin) — это мультибелковый комплекс, в состав которого входит серин-треониновая протеинкиназа mTOR и ряд дополнительных белков. Этот комплекс является мишенью препарата рапамицина и активируется факторами роста, аминокислотами или кислородом. mTOR участвует во многих метаболических процессах — липогенезе, регуляции гомеостаза глюкозы, активации трансляции, аутофагии. В центральной нервной системе (ЦНС) mTORС1 запускает каскад сигнальных событий, которые приводят к активации трансляции синаптических белков, обеспечивающих передачу нервных импульсов. Таким образом, mTORC1 важен для процессов обучения и формирования памяти. С нарушениями работы mTORC1 связывают различные нейродегенеративные процессы, такие как болезнь Альцгеймера и Паркинсона, нарушения развития и некоторые психиатрические расстройства.
В последнее время больше внимания стали уделять роли mTORC1 в развитии алкоголизма. Ранее было показано, что у мышей mTORC1 активируется под воздействием алкоголя в структурах головного мозга, участвующих в формировании зависимостей и принятии решений — прилежащем ядре (NAc, nucleus accumbens) в полосатом теле и орбитофронтальной коре в лобных долях соответственно.
Проблема использования mTORC1 в качестве мишени для лекарственных средств состоит в том, что mTOR важен для многих метаболических процессов, и его тотальное ингибирование приводит к развитию тромбоцитопении, предиабета, плохой заживляемости ран и падению иммунитета.
В новой работе ученые разрабатывали такой метод блокировки mTORC1, который приводил бы к выключению фермента не во всем организме, а только в головном мозге мышей. С этой целью использовали способность ингибитора mTOR — RapaLink1 — связываться с шапероном FKBP12 (FK506 binding protein 12) перед воздействием на киназу mTOR. Авторы исследования синтезировали небольшую молекулу, связывающуюся с этим шапероном, которая получила название RapaBlock.
Мышам вводили или только препарат RapaLink1, или RapaLink1 в комбинации с RapaBlock и смотрели активность mTORC1 в печени по фосфорилированию белков-мишеней mTOR. Также исследовали состояние печени и измеряли вес мышей. Оказалось, что комбинация двух препаратов позволяет сохранить активность mTOR в печени. RapaBlock предохраняет мышей от потери веса и воспалительных процессов в печени, вызываемых RapaLink1.
Отдельной группе мышей длительное время вводили только RapaBlock, чтобы выяснить его воздействие на поведение мышей, в том числе связанное с алкогольной зависимостью. Изменение поведения могло бы означать, что RapaBlock проникает в мозг через гематоэнцефалический барьер (ГЭБ). Поскольку мыши вели себя как обычно, ученые сделали вывод, что препарат не проходит через ГЭБ.
Мышам, приученным к алкоголю, вводили RapaLink или оба препарата. Такая терапия приводила к снижению алкогольной зависимости (мышь переставала искать или пытаться раздобыть алкоголь тем способом, которым была предварительно обучена). Таким образом, RapaBlock, не проходя через ГЭБ, не мешает действию ингибитора RapaLink1 в мозге, но при этом защищает другие органы от действия этого препарата.
Источник
Yann Ehinger, et al. // Brain-specific inhibition of mTORC1 eliminates side effects resulting from mTORC1 blockade in the periphery and reduces alcohol intake in mice// Nature Communications volume 12, 4407 (2021) DOI: 10.1038/s41467-021-24567-x








 Меню
Меню





 Все темы
Все темы




 0
0