Новый фермент для редактирования ДНК помогла создать электронная микроскопия
В университете штата Техас исследовали конформации нуклеазы Cas9 во время взаимодействия с нецелевыми последовательностями ДНК, похожими на целевую. Полученные результаты подсказали, какие аминокислотные остатки следует заменить, чтобы получить модифицированный фермент SuperFi-Cas9. Он разрезает ДНК-мишень так же активно, как немодифицированный, а нецелевое разрезание резко снижено по сравнению с обычным CRISPR-Cas.
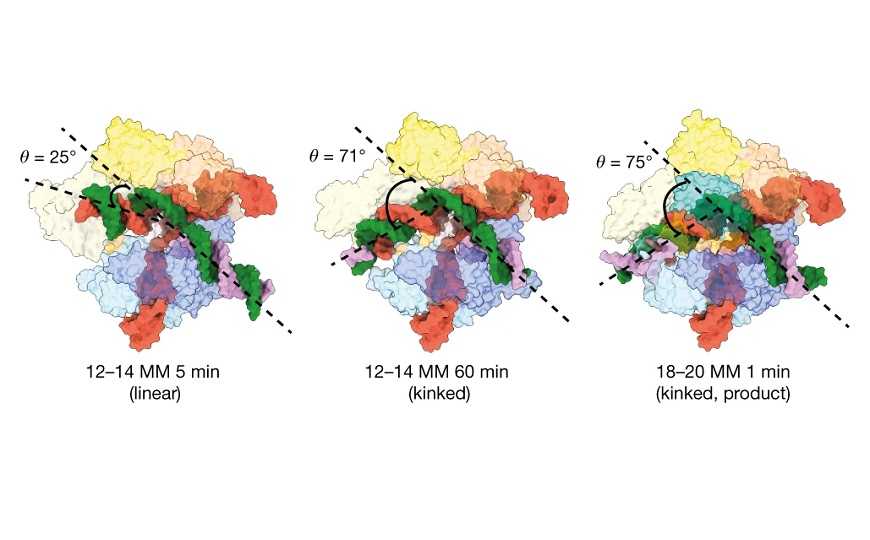
Чем сильнее изгиб дуплекса, тем вероятней нецелевое редактирование.
Credit:
Nature (2022). DOI: 10.1038/s41586-022-04470-1 | CC 4.0
Известная проблема геномного редактирования с помощью CRISPR-Cas9 — нецелевое редактирование, то есть разрезы в участках, похожих на мишени. Более точные варианты Cas9, сконструированные искусственно, обычно уступают исходному варианту фермента в эффективности. Исследователи из Университета штата Техас (Остин) создали новую версию Cas9 для геномного редактирования, которая разрезает последовательность-мишень так же успешно, как и «дикий тип», и при этом намного точнее. Новый фермент получил название SuperFi-Cas9. Один из ведущих авторов работы Кеннет Джонсон считает, что эта разработка способна поменять правила игры в генном редактировании.
Известно, что три несовпадающих нуклеотида в положениях 18–20, считая от мотива, примыкающего к протоспейсеру (PAM), снижают эффективность разрезания примерно в 40 раз, тогда как несовпадения в позициях 6-8, 9-11 и 15-17 — в 2000 раз, так что за 2 часа инкубации расщепляется только 20% ДНК.
Авторы работы использовали криоэлектронную микроскопию, управляемую кинетикой (kinetics-guided cryo-electron microscopy), чтобы определить, какие структурные элементы Cas9 делают возможным нецелевую активность. Сначала они исследовали, как фермент взаимодействует с ДНК, в которой несоответствия находятся в положениях 12–14 от PAM. Оказалось, что Cas9 в таких образцах демонстрирует две конформации: с линейным и с изогнутым («каноническим») дуплексом РНК-ДНК, причем вторая наблюдается в образцах после более продолжительной инкубации. Поэтому исследователи предположили, что линейный дуплекс — это ранний интермедиат, который возникает перед тем, как эндонуклеазный домен HNH примет нужное положение.
Когда авторы изучили взаимодействия Cas9 с ДНК при несоответствиях в положении 18-20, где нецелевое редактирование идет относительно активно, они снова наблюдали линейную и изогнутую конформации. Они обратили внимание на два домена, которые соединяют HNH с остальной частью Cas9 и создают изгиб. Этот изгиб облегчает целевое расщепление, но он же делает возможным нецелевое. Особенно способствовала активации Cas9 при нецелевой активности реорганизация петли в домене RuvC.
«Это как если бы у вас был стул, одна из ножек которого сломалась, и вы просто примотали ее скотчем, — сказал один из двух первых авторов Джек Браво. — Он все еще может работать как стул, но немного шаткий».
Чтобы «починить стул» — не позволять Cas9 разрезать ДНК, если соответствие последовательности и гидовой РНК неполное, — все семь аминокислотных остатков, стабилизирующих нецелевое взаимодействие, заменили на аспарагиновую кислоту. Получилась конструкция, которая разрезает целевой участок почти так же эффективно, как исходная Cas9, но при этом разрезание молекул с несоответствием в позициях 18-20 снизилось в 500 раз.
Авторы работы отметили, что до сих пор они тестировали SuperFi-Cas9 только на ДНК in vitro, но теперь вместе с коллабораторами проверят эффективность на живых клетках.
Источник
Bravo, J.P.K., et al. Structural basis for mismatch surveillance by CRISPR–Cas9 // Nature (2022). DOI: 10.1038/s41586-022-04470-1


 Меню
Меню





 Все темы
Все темы




 0
0