Новый способ подавления гликозилирования в раковой клетке замедляет рост глиобластомы у мышей
Выживаемость при глиобластоме остается низкой, поэтому требуются новые методы терапии. Исследователи из США и Франции показали, что для роста глиобластомы очень важна работа гексозаминового биосинтетического пути, так как опухолевые клетки в больших количествах потребляют гликозилированные белки и липиды. Ингибирование фермента гексозаминового пути PGM3 подавляет рост опухоли и повышает выживаемость мышиной модели.

Глиобластома остается одним из самых смертоносных видов рака с крайне низкой выживаемостью, несмотря на интенсивное лечение: медиана выживаемости составляет всего 12–16 месяцев после постановки диагноза. Ученые продолжают искать новые методы терапии. В новой работе группа исследователей из США и Франции обнаружила ключевую роль фермента PGM3 в росте глиобластомы и предложила использовать его в качестве терапевтической мишени.
Опухолевые клетки, включая клетки глиобластомы, в больших количествах потребляют гликозилированные белки и липиды, необходимые для быстрого роста и деления. Их синтез напрямую зависит от гексозаминового биосинтетического пути, обеспечивающего образование UDP-GlcNAc (уридиндифосфат N-ацетилглюкозамина) — важнейшего субстрата для модификации липидов и белков. Активность этого метаболического пути повышена при многих типах рака. Ранее основным подходом к его подавлению была блокировка лимитирующего фермента GFAT1, однако авторы показали, что для глиобластомы такая стратегия недостаточно эффективна.
Чтобы выяснить причину устойчивости глиобластомы к ингибированию фермента GFAT1, исследователи провели комплексный анализ активности ферментов гексозаминового пути в различных клеточных линиях глиобластомы. В работе применялись как фармакологическое подавление GFAT1 (с использованием азасерина), так и снижение его экспрессии с помощью РНК-интерференции. Дополнительно авторы проанализировали уровни экспрессии ключевых ферментов синтеза и утилизации гексозаминов (GFAT1, GNPNAT1, PGM3, UAP1, NAGK), а также провели изотопное мечение метаболитов для оценки метаболической активности этих путей. Оказалось, что глиобластома способна компенсировать блокаду GFAT1 за счет активации альтернативного пути утилизации гексозаминов, опосредованного ферментом NAGK. В результате ингибирование одного только GFAT1 не оказывает выраженного антипрофилеративного эффекта. Но совместное ингибирование NAGK с GFAT1 или GNPNAT1 позволяло преодолеть резистентность клеток.
В поисках более эффективной мишени исследователи сосредоточили внимание на ферменте PGM3, который регулирует метаболический поток как в процессе de novo синтеза гексозаминов из глюкозы, так при их утилизации. Экспериментальные данные показали, что ингибирование PGM3 оказывает гораздо более выраженное противоопухолевое действие по сравнению с подавлением других ферментов гексозаминового пути. Блокировка PGM3 сопровождалась снижением экспрессии ряда ключевых ферментов этого пути, а также существенным подавлением SREBP-1 — основного транскрипционного фактора, контролирующего липидный метаболизм. Учитывая, что глиобластома активно использует липиды для роста, угнетение SREBP-1 оказалось особенно значимым. Более того, было установлено, что ингибирование PGM3 снижает уровень гликозилирования, угнетает экспрессию GFAT1, GNPNAT1 и UAP1 (при сохранении уровня NAGK), уменьшает степень N-гликозилирования и содержание белка SCAP.
Дальнейшие эксперименты позволили выявить новый, ранее не описанный механизм, объясняющий высокую эффективность ингибирования PGM3. Было установлено, что между активностью SREBP-1 и синтезом гексозаминов существует положительная обратная связь. SREBP-1, помимо регуляции липидного обмена, активирует также транскрипцию ключевых ферментов гексозаминового пути, включая GFAT1, GNPNAT1, PGM3 и UAP1. Достаточный уровень гексозаминов способствует N-гликозилированию белка SCAP, необходимого для активации самого SREBP-1. Блокировка PGM3 разрывает эту самоподдерживающуюся цепь, что ведет к одновременному снижению синтеза гексозаминов и ослаблению активности SREBP-1, в результате чего эффективно подавляется рост глиобластомы.
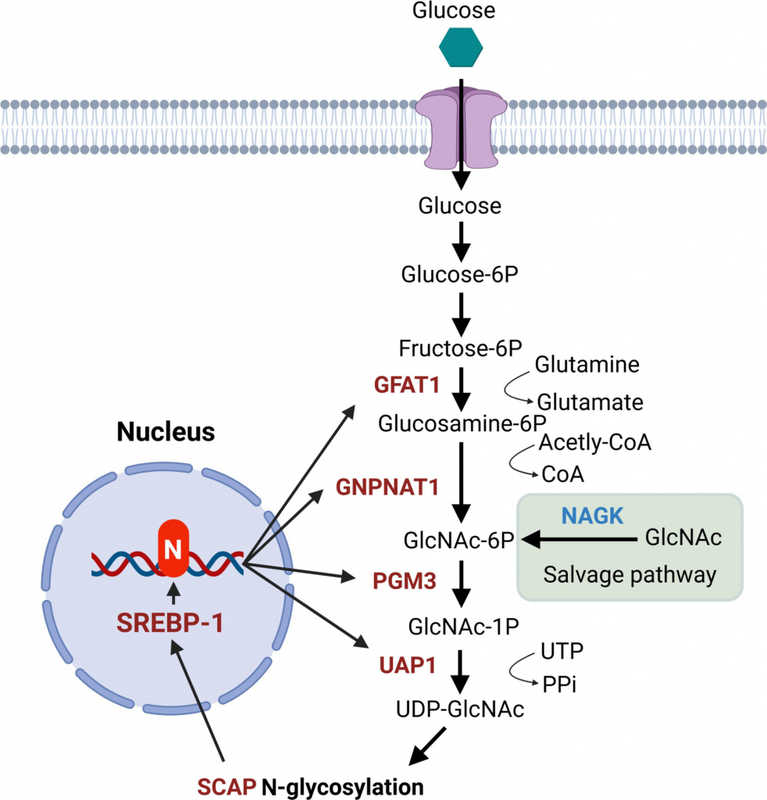 Схематическое изображение, иллюстрирующее положительную обратную связь между активацией SREBP-1 и синтезом гексозаминов. SREBP-1 усиливает экспрессию ферментов гексозаминового пути. Это, в свою очередь, стабилизирует белок SCAP, необходимый для активации самого SREBP-1, за счет повышения его N-гликозилирования, формируя положительную обратную связь. Credit: Huali S., et al. Sci. Adv. 11, DOI:
10.1126/sciadv.adq0334.
Схематическое изображение, иллюстрирующее положительную обратную связь между активацией SREBP-1 и синтезом гексозаминов. SREBP-1 усиливает экспрессию ферментов гексозаминового пути. Это, в свою очередь, стабилизирует белок SCAP, необходимый для активации самого SREBP-1, за счет повышения его N-гликозилирования, формируя положительную обратную связь. Credit: Huali S., et al. Sci. Adv. 11, DOI:
10.1126/sciadv.adq0334.
Для оценки терапевтического потенциала PGM3 исследователи провели серию экспериментов на мышиной модели. Подавление активности PGM3 с помощью РНК-интерференции значительно тормозило рост глиобластомы и увеличивало выживаемость животных. Напротив, ингибирование GFAT1 или NAGK практически не влияло на прогрессирование заболевания и продолжительность жизни мышей.
За последние два десятилетия методы терапии глиобластомы практически не претерпели значительных изменений. В связи с этим выявление новых уязвимостей опухоли приобретает особую актуальность. PGM3 представляет собой перспективную терапевтическую мишень, поскольку его ингибирование нарушает критически важный метаболический контур, поддерживающий рост опухоли. Авторы работы полагают, что таргетирование PGM3 может оказаться эффективным не только при глиобластоме, но и при других формах рака, для которых характерна высокая зависимость от гексозаминов и липидов.
Активация ретротранспозонов в геноме глиобластомы повышает эффективность иммунотерапии
Источник:
Huali S., et al. Targeting PGM3 abolishes SREBP-1 activation-hexosamine synthesis feedback regulation to effectively suppress brain tumor growth. // Sci. Adv. 11, eadq0334 (2025). DOI: 10.1126/sciadv.adq0334


 Меню
Меню





 Все темы
Все темы




 0
0







