Определены особенности стрептомицетов — сильных продуцентов вторичных метаболитов
Геномы стрептомицетов содержат множество кластеров биосинтетических генов, которые кодируют разнообразные вторичные метаболиты, в том числе антибиотики. Однако в природе далеко не все эти кластеры активны. Американские ученые описали два механизма, которые отличают слабые штаммы-продуценты от сильных — полиморфизмы промоторе и инделы на участке от сайта связывания регуляторного белка AdpA до точки начала транскрипции.
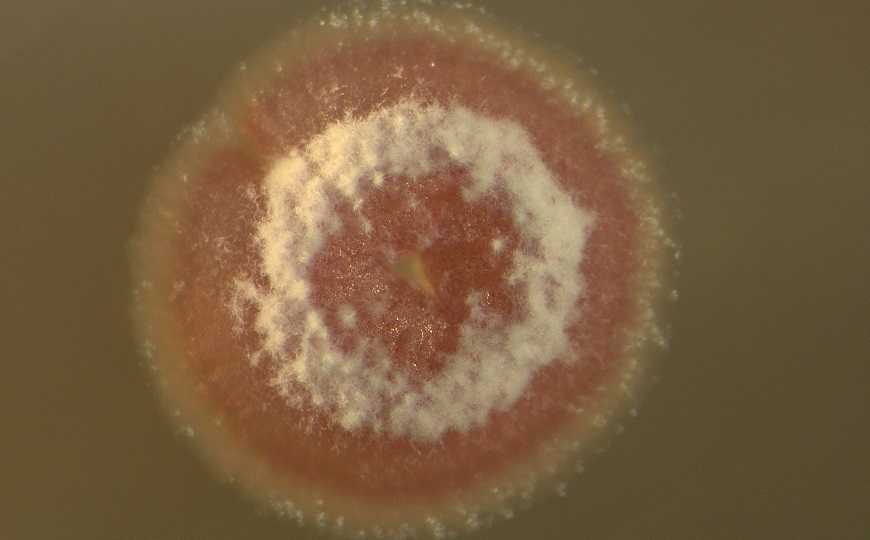
Бактерии рода Strepromyces и другие актинобактерии — источники многих лекарственных веществ, прежде всего антибиотиков. В геноме стрептомицетов содержится огромное количество кластеров биосинтетических генов (biosynthetic gene clusters, BGCs), которые обеспечивают производство разнообразных биологически активных низкомолекулярных соединений. Однако в лабораторных условиях существенная доля BGC стрептомицетов остается неактивной, что существенно осложняет изучение кодируемых ими веществ.
Ученые из Университета Вашингтона в Сент-Луисе с помощью сравнительного метаболомного и геномного анализа выяснили, почему некоторые штаммы Strepromyces — активные продуценты вторичных метаболитов, а другие — слабые продуценты с преимущественно молчащими BGC. Результаты работы опубликованы в PNAS.
В качестве модельного вторичного метаболита исследователи рассматривали полициклические тетрамат макролактамные (polycyclic tetramate macrolactam, PTM) антибиотики. Выбор PTM в качестве модели был связан с тем, что соответствующий BGC включает всего три гена и имеется в геномах многих штаммов стрептомицетов. Авторы сравнивали геномы и способность к продукции PTM у различных штаммов Streptomyces griseus, часть из которых является выраженным продуцентом PTM, а часть не продуцирует PTM вовсе.
Оказалось, что гетерогенность штаммов обусловлена различиями в промоторах BGC, кодирующих PTM у разных штаммов. У более выраженных продуцентов соответствующий BGC находится под более сильным промотором и потому активнее транскрибируется. Сила промотора в данном случае была связана с полиморфизмами в элементе -35 — важном регуляторном сайте бактерий.
Исследователи выяснили, что у S. griseus первый ген BGC, ответственного за продукцию PTM — ftdA — имеет длинную 5’-нетранслируемую область, в которой находится предполагаемый сайт связывания белка AdpA. Это один из важнейших регуляторных белков стрептомицетов, контролирующих, в числе прочего, продукцию стрептомицина и других антибиотиков. Оказалось, что связывание AdpA активирует образование PTM. Примечательно, что предполагаемый сайт связывания этого белка находится после консервативного элемента -10, что нетипично для сайтов связывания активаторов транскрипции.
Ученые показали, что полиморфизмы в участке связывания AdpA также могут, хотя и незначительно, влиять на уровень синтеза PTM. Тем не менее, участок длиной 28 нуклеотидов между точкой начала транскрипции и сайтом связывания AdpA оказался критически важен для регуляции синтеза PTM. Среди штаммов S. griseus этот участок демонстрирует высокую гетерогенность, и наличие в нем специфического индела является главным фактором, отличающим слабые и сильные штаммы-продуценты PTM.
Авторы исследования также выяснили, что между путями биосинтеза PTM и пигмента гризеохордина существует тесная связь. Штаммы S. griseus, продуцирующие PTM на низком уровне, как правило, неспособны к синтезу гризеохордина.
Источник
Yunci Qi, et al. // A comparative metabologenomic approach reveals mechanistic insights into Streptomyces antibiotic crypticity // PNAS, 2021, 118 (31), e2103515118, DOI: 10.1073/pnas.2103515118


 Меню
Меню





 Все темы
Все темы




 0
0