Опухолеобразованию в молочной железе препятствуют несколько механизмов
Онкогенные мутации в тканях здоровых людей встречаются достаточно часто, но не все из них приводят к образованию опухолей. Команда ученых из Нидерландов и Бельгии выяснила в экспериментах на мышах, какие механизмы защищают молочную железу от распространения онкогенных клонов клеток. Благодаря им большинство клеток, несущих потенциально опасные мутации, не доживают до онкогенной трансформации.
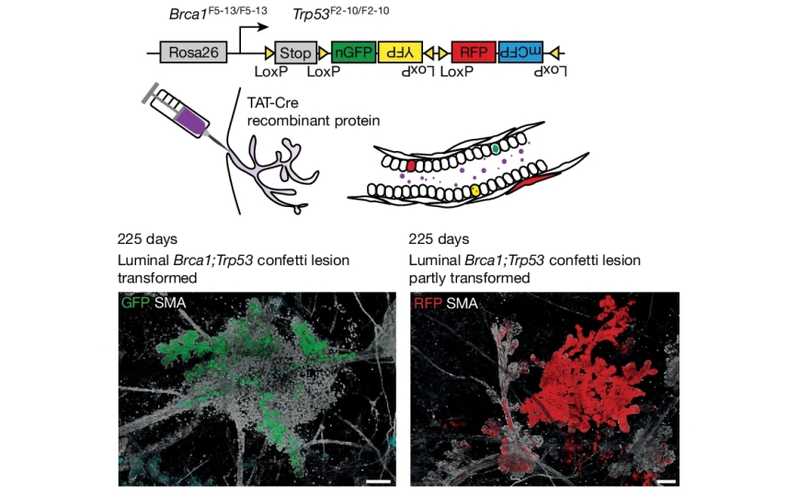
Схема получения мыши confetti. Внизу — распространение мутантных клеток, окрашенных флуоресцентными белками, в молочной железе животного
Credit:
Nature (2024). DOI: 10.1038/s41586-024-07882-3 | CC BY 4.0
Авторы новой статьи в Nature обнаружили защитные механизмы, которые препятствуют росту и распространению клеток с онкогенными мутациями в здоровой молочной железе мыши. Выяснилось, что таких механизмов как минимум три.
Генетические аберрации в онкогенах и генах-супрессорах опухолей считаются главными драйверами опухолеобразования. Примерно у 70% женщин с мутациями в BRCA1 или BRCA2, двух хорошо изученных генах-супрессорах опухолей, до 80 лет развивается рак молочной железы. Однако недавние исследования показали, что клетки с мутациями в ключевых драйверных генах, таких как P53, присутствуют в различных тканях здоровых людей, включая ткани молочной железы. Число мутантных клеток может расти из-за высокой частоты независимо возникающих мутаций или широкого распространения изначально небольшого количества мутантных клеток. При этом далеко не каждая онкогенная мутация приводит к возникновению опухоли. Тем не менее клеточные механизмы, которые защищают ткани молочной железы от накопления или распространения мутантных клеток, остаются малоизученными.
Эпителий, выстилающий разветвленную сеть молочных протоков, состоит из внешнего слоя базальных клеток и внутреннего, то есть обращенного в проток, слоя люминальных клеток, среди которых есть положительные и отрицательные по гормональным рецепторам (HR+ и HR−). Во время эстрального цикла (аналог менструального цикла у мышей) эстроген воздействуют на HR+-клетки, которые секретируют сигнальные факторы, вызывающие скоординированную пролиферацию и ремоделирование клеток эпителия. Концентрация эстрогена достигает пика во время овуляции, после чего из разросшегося эпителия молочных протоков возникают так называемые альвеолы, способные к продукции молока. Если цикл не завершается беременностью, организм «понимает», что эти альвеолы не имеют смысла, и в конце цикла они разрушаются. Этот механизм позволяет элиминировать большинство мутантных клеток, хотя некоторые мутантные клоны могут сохраниться и начать распространяться.
В эпителии молочной железы есть долгоживущие унипотентные стволовые клетки (mammary stem cells, MaSC), и их короткоживущие потомки. Количество и пространственное распределение потомков MaSC изучены плохо, поэтому было неясно, связана ли канцеризация молочных желез с пролиферацией и распространением мутантных клонов, возникших в одном месте или сразу в нескольких местах, и существуют ли защитные механизмы, ограничивающие этот процесс.
Чтобы выяснить это, ученые из Нидерландов и Бельгии проследили судьбу клеток эпителия молочной железы мыши, приобретающих мутации. Для этого использовали линию мышей confetti, клетки которых содержат генетическую конструкцию на основе Cre-LoxP. При воздействии вещества-индуктора клетки животного случайным образом помечаются одним из четырех флуоресцентных белков. В данном случае метили только клетки эпителия протоков молочной железы — в протоки просто вводили рекомбиназу TAT-Cre. У данной линии мышей в клетках эпителия помимо «включения» флуоресцентного белка повреждались гены Brca1 и Trp53. В результате большинство клеток с цветными метками также несли мутации, способствующие опухолеобразованию, и можно было наблюдать за судьбой этих клеток и их потомков.
У мышей в течение 200–250 дней развивались пальпируемые опухоли молочных желез. Большинство клонов, прошедших опухолевую трансформацию, происходили от люминальных клеток. Примечательно, что не все меченые клетки прошли трансформацию, — аномальный фенотип, изменяющий морфологию протоков, приобрело меньшинство. Однако авторы изолировали трансформированные клетки и клетки с нормальным фенотипом и убедились, что хромосомные аберрации присутствовали и в тех, и в других (чего и следовало ожидать от клеток, дефектных по Brca1 и Trp53).
В следующем эксперименте авторы сравнили распространение меченых мутантных клеток и клеток дикого типа. И те, и другие распространялись на большие участки протокового эпителия; это явление назвали «колонизацией поля».
Исследователи обнаружили, что MaSC распределены вдоль протока равномерно, а размеры клонов отдельных клеток сильно варьируют, однако подчиняются лог-нормальному распределению — то есть большинство клонов невелико, а меньшинство достигает значительной численности. Это сдерживание обеспечивается тремя факторами. Большая часть MaSC производит лишь малое число короткоживущих клеток-потомков, что снижает вероятность опухолевой трансформации. Кроме того, во время циклических гормональных изменений гибнут и короткоживущие, и долгоживущие клетки; расширение клонов сменяется их потерей. Наконец, колонизации поля препятствует линейная организация клеток эпителия протоков; геометрическое ограничение затрудняет вытеснение соседних нормальных клеток. Однако клетки, расположенные в концевой части протока, имеют больше пространства для роста и, соответственно, больше шансов на приобретение мутаций и превращение в раковые клетки.
Затем ученые исследовали, как судьба мутантных клонов изменяется во время беременности, связанной с масштабным ремоделированием ткани. Оказалось, что значительных изменений в размерах клонов у рожавших мышей не происходило. Дальнейшее исследование размеров мутантных клонов показало, что у мышей с потомством было относительно мало крупных клонов, возможно, из-за пропуска нескольких циклов эструса. Эти данные подтверждают результаты исследований, демонстрирующих защитную роль ранней беременности против рака груди. Овариэктомия у мышей также подавила распространение клонов и восприимчивость к трансформации.
Сложность структурной и гормональной регуляции судеб клеток молочной железы подчеркивает важность раннего обнаружения онкогенных клонов и мониторинга их динамики во время цикла. Полезной может быть интеграция гормонального профиля с обнаружением онкогенных мутаций в циркулирующей опухолевой ДНК, отмечается в комментарии Nature. Однако переносить на человека результаты, полученные на мышах, необходимо с осторожностью.
Источник
Ciwinska, M., et al. Mechanisms that clear mutations drive field cancerization in mammary tissue // Nature 633, 198–206 (2024). DOI: 10.1038/s41586-024-07882-3


 Меню
Меню





 Все темы
Все темы




 0
0