Петр Чумаков: как сделать онколитический вирус и на что он способен
Просто и понятно о трех естественных механизмах сдерживания рака, иммунотерапии ингибиторами контрольных точек и наконец, о вирусах, которые убивают раковые клетки, рассказывает Петр Михайлович Чумаков в лектории «Метафаза».

Заключительная лекция блока «Вирусы» научно-просветительского проекта «Метафаза» от PCR.NEWS и парка «Зарядье» была посвящена онколитическим вирусам. Член-корреспондент РАН Петр Михайлович Чумаков (Институт молекулярной биологии им. В.А. Энгельгардта РАН) рассказал о механизме работы такой терапии и о перспективах ее развития как в мире, так и в нашей стране.
Почему рак трудно вылечить
Несмотря на многолетние исследования, направленные на поиск препаратов и разработку технологий для терапии и диагностики рака, до сих пор растут заболеваемости и смертности от онкологических заболеваний. Если болезнь диагностируется на ранней стадии, то современная медицина может помочь пациенту, но на поздних стадиях даже самые современные методы не гарантируют выздоровления. Например, статистика по раку легкого в США показывает, что пятилетняя выживаемость больных значительно снижается, если болезнь диагностируют на 3-й или 4-й стадии по сравнению с более ранними. В 57% случаев рак легкого диагностируют на 4-й стадии, когда уже присутствуют отдаленные метастазы, и в этом случае пятилетняя выживаемость — всего 5%. Похожая ситуация и с другими опухолями: для рака поджелудочной железы на 4-й стадии пятилетняя выживаемость только 2%, а для глиобластомы — 4%.
При метастатическом раке сейчас в основном используют цитостатическую химиотерапию. Такие препараты убивают не только раковые клетки, но и нормальные, а также подавляют иммунитет. Широко разрабатываются и более продвинутые препараты — таргетные, которые действуют только на раковые клетки и не затрагивают нормальные. Несмотря на эффективность, такие препараты очень дорогостоящие и не гарантируют, что не будет рецидива.
Проблема лечения рака состоит в том, что раковые клетки легко приобретают резистентность. Любая клетка располагает несколькими сценариями, которые помогают выжить в тяжелых условиях, но раковая клетка эгоистична и прибегает к этим сценариям, чтобы выжить под действием терапии. Поэтому, если воздействовать только на какой-то один параметр в клетке, то рано или поздно она приобретет мутации и станет резистентна к такому воздействию. Это напоминает бактерии, которые также стараются приобрести устойчивость к антибиотикам.
Химиотерапия чаще всего не направлена на саму причину болезни. Опухоли появляются не из-за присутствия раковых клеток, а из-за того, что иммунная система недостаточно эффективно удаляет их. У каждого человека постоянно в организме появляются раковые клетки, но они тут же удаляются иммунитетом. Существует расхожее заблуждение, согласно которому рак развивается, когда к старости накапливаются мутации. На самом же деле в старости просто повышается частота мутаций, а иммунная система при этом ослабевает, поэтому раковые клетки могут ускользнуть от ее надзора и образовать скопления — опухоли. Следовательно, терапия будущего должна уметь восстанавливать естественную способность организма уничтожать раковые клетки.
Иммунная система против рака: бесконечная битва
В организме есть несколько механизмов, направленных на устранение раковых клеток. На внутриклеточном уровне это апоптоз — программируемая клеточная гибель, самоубийство, которое клетка совершает при возникновении мутаций, сильных стрессов или сбоев регуляции. Этот процесс регулируется белком p53. В норме, если клетка каким-то образом отклоняется от предписанной ей программы, то она уходит в апоптоз. В раковых клетках этот механизм нарушен.
Еще два механизма связаны непосредственно с иммунитетом — с врожденным и адаптивным. Врожденный иммунный надзор осуществляют NK-клетки, которые распознают и уничтожают ненормальные клетки. Они «обнюхивают» каждую клетку и ищут на ней маркеры, которые говорят о ее нормальности: например, на поверхности нормальной клетки должен присутствовать MHC I. Если же происходит злокачественная трансформация клетки, то с ее поверхности пропадает молекула MHC, такая клетка лишается флажка «не ешь меня». В этом случае NK-клетка выбрасывает смесь веществ, которые разрушают мембрану клетки, и это приводит к ее гибели.
Адаптивный иммунный надзор связан с формированием клеточного иммунного ответа на неоантигены опухолевых клеток. Обычно этот механизм запускается уже на поздних стадиях, когда раковые клетки накапливают мутации. Неоантигены выявляются дендритными клетками, которые после обучения мигрируют в лимфоузлы и передают это знание Т-хелперам. Те, в свою очередь, обучают цитотоксические CD8+ Т-клетки, а уже они убивают опухолевые клетки.
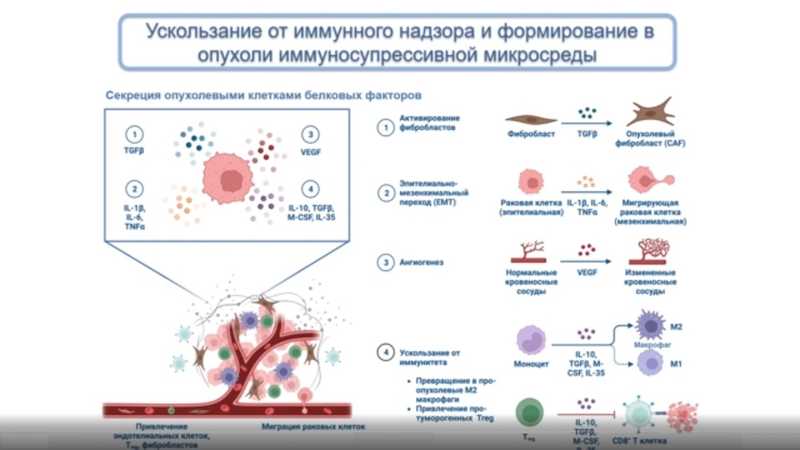
Однако раковые клетки приспособились ускользать от иммунного надзора. Они могут секретировать факторы, которые способствуют разрастанию вокруг опухоли сосудистой сети (так в опухоль поступают питательные вещества) или привлекают в опухоль компоненты иммунной системы. В этом случае иммунные клетки, которые инфильтрируют опухоль, превращаются в ее союзников. Например, в норме моноцит превращается в М1-макрофаг, который обладает противоопухолевыми функциями. Но под влиянием фактора TGFβ, который может выделяться опухолью, такой моноцит становится М2-макрофагом и обеспечивает опухоль метаболитами, помогающими ей выжить. К опухоли также мигрируют фибробласты, и в итоге они образуют иммунносупрессивную строму, через которую не могут проникнуть иммунные клетки.
Еще один механизм ускользания от иммунного надзора связан с экспрессией на опухолевых клетках определенных молекул — иммунных контрольных точек. Например, на лимфоците экспрессируется белок PD-1, а на опухоли — его лиганд PD-L1. Когда лимфоцит взаимодействует с раковой клеткой, иммунная клетка «выключается» либо переходит в апоптоз. В норме иммунные контрольные точки нужны для регуляции активности и играют роль тормозов для прекращения воспаления, но раковые клетки используют эти молекулы в свою пользу.
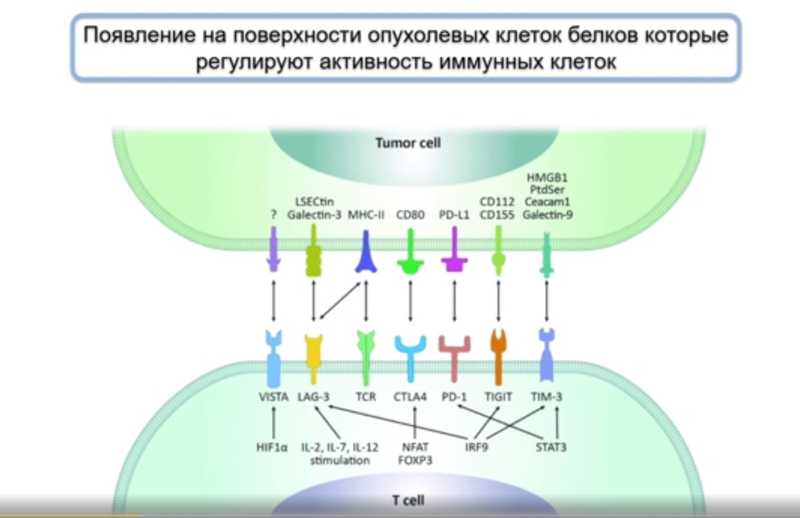
Существуют разные подходы к иммунотерапии. Пассивная иммунотерапия является как бы заместительной и включает введение цитокинов или NK-клеток, чтобы воздействовать на раковые клетки за счет естественных механизмов. К активной иммунотерапии можно отнести раковые вакцины на основе пептидов или мРНК. Для создания такой вакцины у пациента выделяют опухолевые антигены, в них выявляют мутации, затем синтезируют пептиды с такой мутацией (или мРНК, кодирующую их). Если ввести пациенту вакцину, содержащую или экспрессирующую такие пептиды, они должны обучать иммунную систему бороться с раком, но такие подходы оказались малоэффективными. Это связано как раз с иммунными контрольными точками: за счет этого механизма опухоль может противостоять даже обученному иммунитету.

В 2018 году Нобелевскую премию по медицине и физиологии присудили за разработку ингибиторов иммунных контрольных точек. Пример такого препарата — пембролизумаб. Это антитело, которое блокирует белок PD-1 и мешает ему взаимодействовать с PD-L1. Ингибиторы иммунных контрольных точек показывают неплохие результаты, особенно в сочетании с химиотерапией, но, подчеркивает Петр Михайлович, не являются панацеей.
Враг моего врага
Для борьбы с раком нужно заставить иммунную систему координированно атаковать опухоль, и решением этой задачи могут стать онколитические вирусы. Способность вирусов размножаться в опухолях была обнаружена больше века назад. Еще в 50-е годы пробовали лечить рак с помощью вирусов, но использовали опасные вирусы, поэтому пациент мог умереть не от рака, а, например, от клещевого энцефалита. На тот момент вирусология находилась на зачаточном этапе, и такие опыты привели к дискредитации вирусной терапии. Только в 1990-х годах, когда ученые начали лучше понимать природу патогенности вирусов и нашли безопасные вирусы (а их в сотни или тысячи раз больше, чем опасных), к этой идее вернулись.
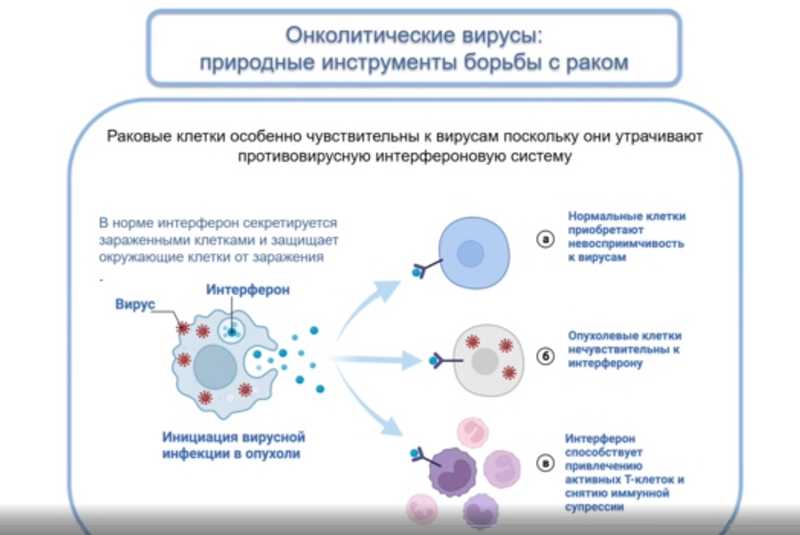
В раковых клетках вирусы способны размножаться лучше, чем в нормальных. Дело в том, что раковые клетки избавляются от всего, что мешает им бесконтрольно размножаться, выбрасывают все организменные функции, которые ей как одноклеточному организму ни к чему. Так, многие раковые клетки избавляются от противовирусной интерфероновой системы. Обычно, если клетка заражена вирусом, она начинает вырабатывать интерферон. Он взаимодействует с интерфероновым рецептором на поверхности нормальных клеток, и те становятся невосприимчивыми к вирусам. У опухолевых клеток такой защиты нет, поэтому вирус успешно размножается в них и превращает опухоль в инфекционный очаг. Даже ослабленные вирусы могут размножаться только в раковых клетках.
Распространяясь от одной клетки к другой, вирус может начать взаимодействовать и с клетками стромы — окружающих тканей. В нормальных клетках противовирусная защита работает, поэтому они начинают выделять интерферон — мощный иммуномодулятор: чувствуя его, клетки начинают вырабатывать хемокины. Эти молекулы привлекают другие иммунные клетки в опухоль, таким образом иммуносупрессивное микроокружение опухоли конвертируется в иммуноактивное. К опухоли могут мигрировать и дендритные клетки, и NK-клетки, и CD8+ Т-клетки, и Т-хелперы, и макрофаги. Так как опухоль из «холодной» превращается в «горячую», восстанавливается способность организма бороться с ней. Это процесс длится несколько месяцев и в итоге приводит к уменьшению размеров опухоли вплоть до ремиссии.
Кроме того, онколитические вирусы могут способствовать появлению системного противоопухолевого ответа. Вирус проникает в клетку и уничтожает ее, гибнущие опухолевые клетки высвобождают свои неоантигены. При этом вокруг опухоли находится уже активное иммуноокружение, поэтому иммунные клетки обучаются на неоантигене, и весь организм становится защищенным от опухоли.
Таким образом, онколитические вирусы селективно размножаются в опухоли, стимулируют и врожденный, и адаптивный иммунитет и снимают иммуносупрессию. Они также усиливают действие ингибиторов иммунных контрольных точек. Обычно эти препараты применяют только в том случае, если опухоль экспрессирует в больших количествах PD-L1, иначе препараты будут бесполезны. При внесении вируса уровень этого белка в опухоли повышается, что дает затравку для комбинированной терапии.
Онколитические вирусы эффективны даже в случае устойчивости опухоли к химиотерапии и к таргетной терапии. Чем более видоизменена клетка, тем лучше вирусы в ней размножаются. Однако есть и нюанс: после длительной химиотерапии иммунитет пациента может быть настолько истощен, что даже при активации за счет вирусов он не сможет эффективно бороться с опухолью.
Обычно применение онколитических вирусов связано с минимумом побочных эффектов. Даже при массивных дозах вируса у пациентов просто повышается температура до 37-38,5℃ в течение нескольких суток.
В качестве онколитических можно использовать любые литические вирусы: аденовирусы, герпесвирусы, энтеровирусы и т. д. Можно применять и слабопатогенные, и непатогенные вирусы человека и животных, и аттенуированные вирусы, и генно-модифицированные вирусы с удаленными генами вирулентности. Вместо них можно добавить гены, которые усиливают терапевтическую активность вируса — в этом случае вирус играет роль вектора. Клетка, зараженная таким вирусом, будет вырабатывать иммуномодулирующие факторы (GM-CSF, IL-12, IL-6, IL-2), хемокины, цитотоксические пептиды (апоптин). В качестве трансгенов можно использовать гены терапевтических антител (анти-PD-1, анти-PD-L1, анти-VEGF и т. д.), гены ферментов, нужные для распространения вирусов в опухоли и др.
Практические примеры
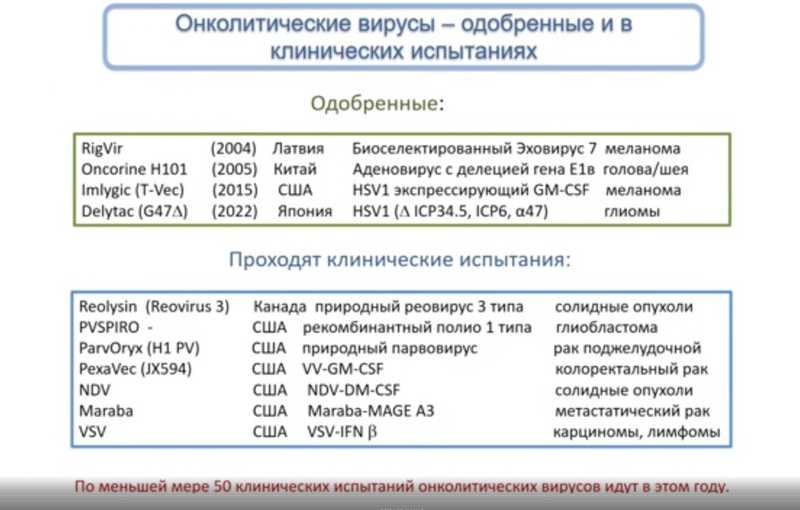
В настоящее время одобрено четыре препарата на основе онколитических вирусов: RigVir, Oncorine H101, T-Vec (Imlygic), Delytac. Проводится как минимум 50 клинических испытаний таких препаратов.
Например, Imlygic представляет собой вирус герпеса, экспрессирующий GM-CSF, и широко применяется для лечения меланомы в сочетании с ингибиторами иммунных контрольных точек. Петр Михайлович рассказал о пациенте с меланомой, у которого также было два очага в печени. Хотя в эту область не вводили вирус, после лечения Imlygic метастазы все равно исчезли, что говорит о системном ответе.
Важный вопрос при использовании онколитических вирусов — подбор способа их введения. Если вводить вирусы в кровоток, то они инактивируются за счет врожденного и адаптивного иммунитета. Если вводить вирусы локально, то гарантированно появится локальный и системный иммунный ответ, но необязательно вирус дойдет до всех опухолевых клеток. В этом случае можно использовать клетки-носители: при биопсии у пациента отбирают чувствительные клетки, которые заражают в пробирке и вводят назад в кровоток. В такой клетке реплицируется вирус, она гибнет, когда попадает к опухоли, и заражает опухоль. Лучше всего, чтобы в качестве носителя выступала иммунная клетка. Например, можно из моноцита получить незрелую дендритную клетку, заразить ее и ввести в кровоток, а под действием хемокинов она прибудет в опухоль. Еще один вариант введения вирусов — в артерию, которая питает опухоль.
Онколитические вирусы достаточно медленно переходят в клинику, так как на каждый из препаратов реагирует только часть пациентов. Например, лечению полиовирусом PVSRIPO поддаются только 20% пациентов с глиобластомой. Это связано с индивидуальной чувствительностью опухолевых клеток пациента к конкретному вирусному штамму. Так, вирус должен проникнуть в клетку через рецептор, а в некоторых опухолях рецептор отсутствует или видоизменен. Петр Михайлович представил результаты собственных исследований, в которых сравнили чувствительность глиобластом пациентов к 36 штаммам вирусов, рака молочной железы — к 35 штаммам; различия были существенными. Непосильно в каждом отдельном случае определять чувствительность опухоли к вирусу, поэтому нужен широкий арсенал терапевтических штаммов.
В лаборатории Петра Чумакова разработали панель на основе непатогенных энтеровирусов. Их выделили из кишечника здоровых детей до 5 лет: считается, что эти непатогенные вирусы неспецифически защищают организм от вирусных инфекций. Исследователи отобрали такие вирусы, которые проникают в клетку через разные рецепторы, чтобы повысить вероятность того, что вирус будет работать. В результате получили препарат «Энтеромикс», который содержит четыре разных штамма: PV RUSSO, Echovirus 7, Coxsackie A21, EV-B75.
Препарат уже используется как «терапия милосердия», его предлагают тяжелым пациентам, которым медицина уже не может помочь. Такие неофициальные испытания проводил коллектив Петра Михайловича в Институте молекулярной биологии им. В.А. Энгельгардта РАН, а официальные клинические испытания намечены на декабрь 2024 года в Московском научно-исследовательском онкологическом институте имени П.А. Герцена. В 73% случаев из побочных эффектов наблюдалась умеренная повышенная температура, в 20% — легкая боль в местах опухолевых очагов, а серьезных побочных эффектов не было. В декабре 2024 года ученые планируют начать официальные клинические испытания препарата для лечения глиобластомы, рака головы и шеи, аденокарциномы кишечника, меланомы и тройного негативного рака молочной железы.
Петр Михайлович поделился несколькими клиническими случаями. У одного пациента была мультиформная глиобластома, ее удаляли дважды, но дважды происходил рецидив. Пациенту внутривенно ввели четыре вируса в составе дендритных клеток, и наступила ремиссия. У другого пациента была диффузная астроцитома, которую смогли удалить только частично, иначе последовала бы потеря функций организма. После того как пациенту внутривенно ввели онколитические вирусы, болезнь стабилизировалась, и спустя два года человек все еще жив. У третьей пациентки был рак яичника с метастазами в брюшину; после введения вируса у нее сократился размер метастазов, и с 2017 года она еще жива. Одна пациентка с раком яичника после лечения онколитическими вирусами не только ушла в ремиссию, но и смогла родить.
Ученые ведут разработку иммуномодулирующих рекомбинантных вирусов Neovaxia для персонифицированной терапии. Это панель вирусов на основе осповакцины, в которую вводят разные иммуномодулирующие факторы: цитокины, хемокины, фотосенсибилизаторы, наноантитела против PD-1 или EGFR, NOX4 — индуктор апоптоза за счет выработки активных форм кислорода, флагеллин холеры — сильный иммуномодулятор.
В заключение Петр Чумаков отметил, что перспективы в терапии рака есть, но нужно рассчитывать на собственные силы организма и воздействовать на причину рака, а не на его проявления. По его мнению, сейчас мы переходим на новый уровень биотерапии рака, и уже в ближайшие 10–15 лет онколитические вирусы могут стать магистральным направлением в онкологии.


 Меню
Меню





 Все темы
Все темы




 0
0






