Пищеварительный тракт in vitro: получена биоинженерная модель толстого кишечника мыши
Ученые создали модель кишечника на чипе, воспроизводящую не только структуру кишечного эпителия, но и взаимодействие клеток хозяина с кишечными бактериями. Главные преимущества модели перед экспериментами in vivo — возможность полностью контролировать условия и визуализация в режиме реального времени.
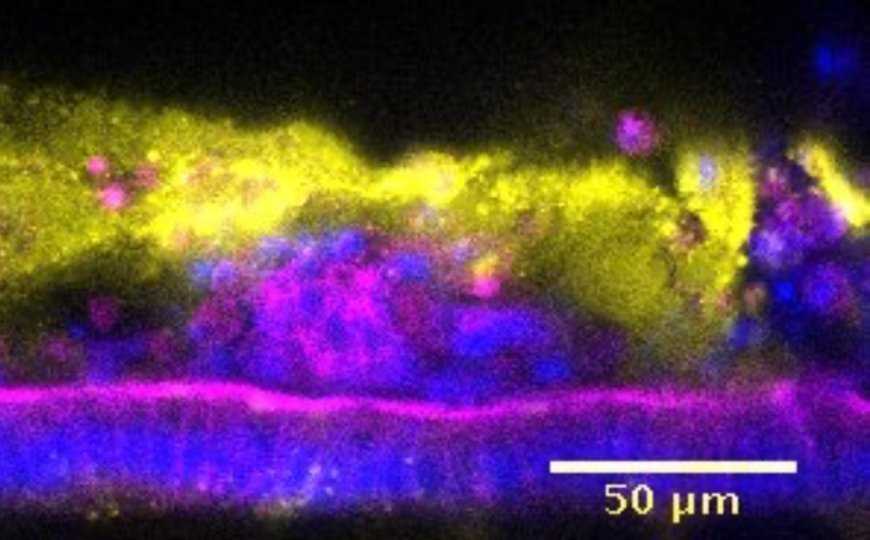
Поперечный разрез поляризованного эпителия, выращенного на мышином кишечном чипе. Пурпурный цвет — актиновые филаменты, желтый цвет — MUC2 (основной компонент кишечной слизи), синий цвет — ядра клеток.
Credit: Wyss Institute at Harvard University |
Пресс-релиз
Используя технологию «органы на чипе», команда исследователей из США и Бразилии создала модели различных отделов кишечника мыши. Наибольшее внимание ученые уделили толстому кишечнику, для полноценного моделирования которого необходимо не только вырастить на чипе кишечный эпителий, но и воспроизвести его колонизацию сообществом кишечных бактерий-симбионтов.
Для органов на чипе, как правило, используют человеческие клетки, однако у мышиных клеток есть преимущества. Так, релевантность моделей можно проверить, сравнивая их ответ на воздействия с ответом, полученным в предварительных экспериментах in vivo. Кроме того, получить образец кишечного эпителия от мыши гораздо проще, чем от человека, а разнообразие специально выведенных линий лабораторных мышей, в том числе гнотобионтных и трансгенных, не имеет аналогов в человеческой популяции.
В экспериментах использовались мыши дикого типа линии C57/Bl6 и трансгенные мыши, в клетках которых актин помечен флуоресцентным белком Kaede, что позволяет визуализировать процессы миграции и деления клеток. Для выращивания органов на чипе ученые выделили отделы тонкого кишечника — двенадцатиперстную, подвздошную и тощую кишку, а также толстый кишечник. Органы были измельчены и тщательно промыты. Из полученной суспензии для дальнейшего культивирования выделили фракцию с наибольшим содержанием целых кишечных крипт. Из этой фракции вырастили кишечные органоиды. Затем их биохимически и механически разделили на отдельные клетки и поместили эти клетки в апикальный канал микрофлюидного чипа.
Неделю спустя клетки образовали непрерывные монослои, аналогичные по структуре эпителию отделов кишечника мыши. Чипы, моделирующие толстый кишечник, через апикальный канал заселили бактериями Salmonella typhimurium (патоген, вызывающий кишечную инфекцию у мышей), Enterococcus faecium (компонент нормальной кишечной микрофлоры человека), человеческим кишечным микробиомом (Hmb) или мышиным микробиомом (Mmb). В некоторых экспериментах чип сначала заселяли E. faecium, Hmb или Mmb, а затем инфицировали S. typhimurium. Для визуализации использовали иммунофлуоресцентную микроскопию. Состав микробиомов определяли методом секвенирования гена 16S рРНК.
Инфицирование стерильного кишечного чипа патогеном S. typhimurium вызвало деградацию слоя слизи, разрушение плотных межклеточных контактов, а затем — повреждение эпителия. Такие же процессы происходят в кишечнике выращенной в стерильных условиях и зараженной мыши. В ответ на угрозу энтероциты синтезировали цитокины, которые in vivo стимулировали бы миграцию лейкоцитов к поврежденному участку.
На кишечных чипах, заселенных видоспецифической мышиной и человеческой микробиотами, устойчивость к S. typhimurium была различной. Наиболее устойчивыми к патогену оказались чипы, на которых преобладали бактерии рода Enterococcus из человеческой микрофлоры. Ученые предположили, что именно энтерококки способствуют этой устойчивости, и доказали это в следующем эксперименте: предварительное заселение кишечного чипа чистой культурой E. faecium также увеличивало устойчивость эпителия к S. typhimurium. Таким образом, полученную биоинженерную модель можно использовать для определения конкретных штаммов, защищающих кишечник от патогенов.
Результаты исследования открывают широкие перспективы для дальнейшего изучения кишечного микробиома и его взаимодействия с хозяином. «Красота методики в том, что практически все изучаемые параметры можно контролировать и легко отслеживать. Создание этой системы — огромный шаг вперед», — утверждает Деннис Каспер, профессор иммунологии в Гарвардской медицинской школе и один из руководителей исследования.
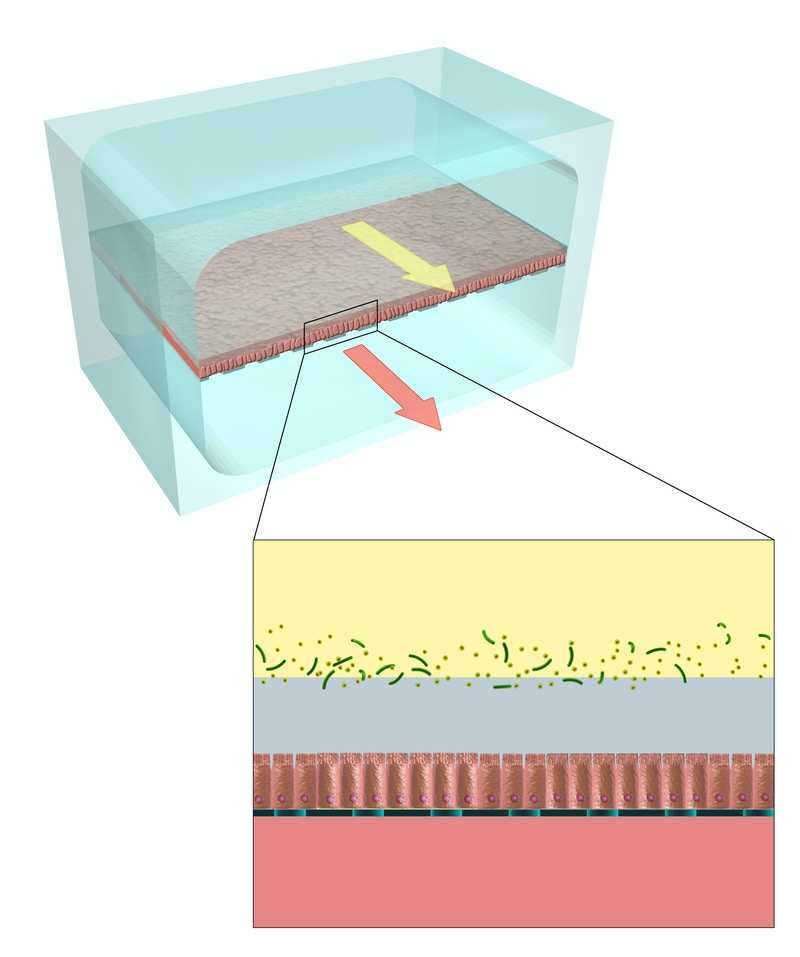 Схема двухканального микрофлюидного кишечного чипа. Базальный канал отделен от апикального пористой мембраной, на верхней стороне которой расположен кишечный эпителий. Чип находится в анаэробных условиях, но через базальный канал протекает насыщенный кислородом раствор. Таким образом, микробиом апикального канала существует в условиях кислородного градиента. Credit: Wyss Institute at Harvard University |
Пресс-релиз
Схема двухканального микрофлюидного кишечного чипа. Базальный канал отделен от апикального пористой мембраной, на верхней стороне которой расположен кишечный эпителий. Чип находится в анаэробных условиях, но через базальный канал протекает насыщенный кислородом раствор. Таким образом, микробиом апикального канала существует в условиях кислородного градиента. Credit: Wyss Institute at Harvard University |
Пресс-релиз
Источник
Gazzaniga, Francesca S., et al. // Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. // Frontiers in Cellular and Infection Microbiology 11, 105 (2021), published online 12 March 2021; DOI: 10.3389/fcimb.2021.638014


 Меню
Меню





 Все темы
Все темы




 0
0








