Плазматические клетки, вырабатывающие блинатумомаб, вылечили мышей от лейкоза
Препараты на основе биспецифических моноклональных антител успешно лечат онкозаболевания. Однако для поддержания терапевтической концентрации антитела пациентам необходимы многодневные курсы инфузий. Альтернативой могут стать инженерные плазматические В-клетки (ePC), которые секретируют нужный белок и способны жить в организме десятилетиями. В экспериментах на мышах ePC, секретирующие антитело против CD19 и CD3 (то есть блинатумомаб) способствовали уничтожению клеток, полученных от пациента с острым лимфобластным лейкозом.
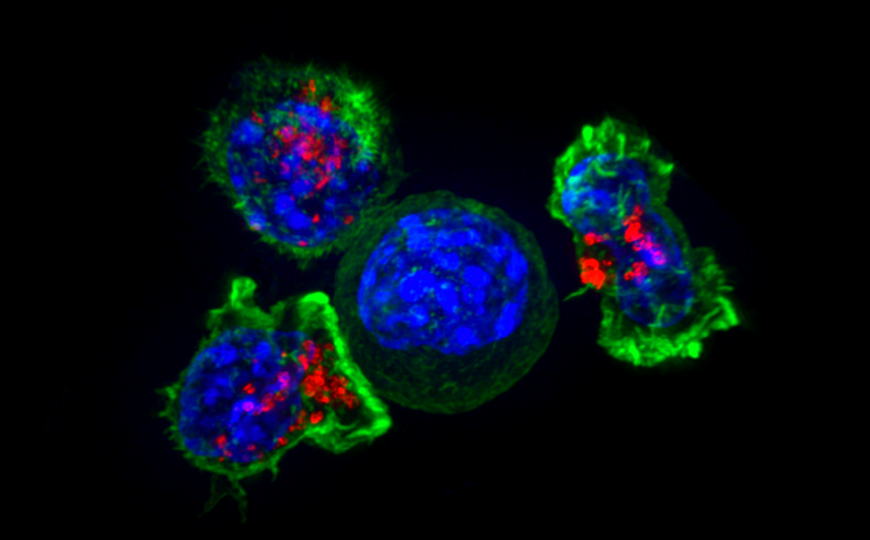
Цитотоксические Т-клетки окружают раковую клетку. Взаимодействию между ними могут способствовать биспецифические антитела
Credit:
NIH | flickr.com
Впервые показано, что инженерные плазматические В-клетки (engineered plasma cells, ePC) могут быть использованы для лечения лейкоза. Результаты эксперимента на гуманизированных мышах опубликованы в журнале Molecular Therapy (Cell Press)
Биспецифические моноклональные антитела (то есть такие, одна молекула которого распознает два разных эпитопа, а не два одинаковых, как природные антитела) уже нашли широкое применение в медицине. Первым в 2014 году получил разрешение блинатумомаб (Блинцито) —биспецифическое антитело для лечения рецидивирующего/рефрактерного В-клеточного острого лимфобластного лейкоза (В-ОЛЛ). Это антитело связывается с белком CD3 на Т-клетках и CD19 на В-клетках, образуя мостик между Т-клеткой и ее мишенью. Препарат хорошо себя показал, в том числе при лечении младенцев. Однако пациентам требуются длительные курсы внутривенных инфузий, что снижает качество жизни и увеличивает риск заражения. Поэтому рассматриваются альтернативные методы доставки, например, клетки, которые могли бы производить биспецифические антитела в организме.
Исследователи под руководством Ричарда Джеймса из Детского исследовательского института в Сиэтле (США) разработали стратегию получения ePC, которые производят большие количества биспецифических антител против клеток В-ОЛЛ или ОМЛ. Клетки получали с помощью CRISPR-Cas9 и гомологически направленной рекомбинации (HDR); редактирующую конструкцию доставляли в аденоассоциированном вирусе. Инженерные клетки секретировали биспецифическое антитело против CD19 и CD3 (то есть блинатумомаб).
«Одной из проблем, с которой мы столкнулись, было то, что биспецифическое антитело, используемое для уничтожения опухолевых клеток, также может связывать сами инженерные плазматические В-клетки, поскольку они экспрессируют тот же целевой белок, — говорит Джеймс. Чтобы преодолеть эту проблему, мы, когда создавали инженерные клетки, удалили [из них ] белок-мишень антитела, CD19. Мы были удивлены, что удаление CD19 не помешало производству инженерных плазматических В-клеток». Более того, нокаут CD19 усилил продукцию биспецифических антител.
Исследователи убедились, что плазматические клетки, секретирующие биспецифические антитела против CD19, проявляют активность in vitro против антигенов лейкемии и опухолевых клеток. Затем перешли к экспериментам на лабораторных животных. Иммунодефицитным мышам ввели и ксенотрансплантаты, полученными от пациентов с острым лимфобластным лейкозом, Т-клетки, аутологичные с ePC (от того же донора), и сами ePC, производящие антитела. Опухолевая нагрузка у мышей, получивших ePC, была существенно ниже, чем в контроле, и уменьшалась со временем. Опухоль удавалось подавить и в том случае, если терапевтические клетки вводили через два дня после раковых.
Интересно, что концентрация биспецифических анти-CD19 антител в сыворотке через месяц после введения клеток и эрадикации опухоли была сопоставима с той, которая наблюдалась у пациентов, получавших регулярные инфузии блинатумомаба. (Для повышения экспрессии понадобилась дополнительная оптимизация конструкции.) Наконец, авторы сравнили анти-CD19-ePC и нацеленные на CD19 (CAR)-T-клетки и увидели сходное противоопухолевое действие.
Исследователи предполагают, что стратегии, основанные на ePC, способны увеличить период полувыведения биспецифических антител у пациентов с острыми лейкозами и другими заболеваниями. Длительные клинически значимые уровни препарата могут быть достигнуты однократным введением ePC. Этим они выгодно отличаются от других секретирующих инженерные антитела клеточных продуктов, таких как макрофаги или Т-клетки. Еще одно преимущество —часть их локализуется в костном мозге и других местах нахождения клеток В-ОЛЛ.
Однако биспецифические ePC следует тщательно исследовать на предмет токсичности. Поражение нормальных В-клеток, несущих ту же мишень, — распространенная проблема у пациентов, получающих анти-В-клеточную терапию. Необходимы дальнейшие исследования на гуманизированных мышах и приматах для полного понимания активности, продолжительности существования и тканевой локализации ePC. Кроме того, для лечения злокачественного новообразования В-клеток может быть сложно сконструировать инженерные клетки из собственных В-клеток пациента, потому что среди них могут оказаться раковые. Альтернативой может быть использование аллогенных продуктов (полученных от здоровых доноров).
«Мы надеемся, что это исследование станет первым из многих применений модифицированных плазменных В-клеток и в итоге приведет к созданию терапии однократного введения, — говорит Ричард Джеймс. — Поскольку модифицированные плазменные В-клетки могут жить очень долго, 10 лет и более, их можно использовать в качестве долгосрочного источника многих биологических препаратов».
Возможно, ePC найдут применение не только в онкотерапии, но и в лечении аутоиммунных заболеваний и патологий, связанных с дефицитом того или иного белка, например, гемофилии. Авторы статьи отмечают, что уже работают в этом направлении.
Источники
Tyler F. Hill, et al. Human plasma cells engineered to secrete bispecifics drive effective in vivo leukemia killing // Molecular Therapy. 2024. DOI: 10.1016/j.ymthe.2024.06.004


 Меню
Меню





 Все темы
Все темы




 0
0








