Предложен метод «переписывания» протяженных участков генома млекопитающих
Ученые из США описали метод mSwAP-In для редактирования генома мышей, позволяющий заменять участки генома длиной около 200 тысяч пар нуклеотидов. Он также дает возможность последовательно «переписывать» участки, примыкающие друг к другу, и таким образом получить сколь угодно длинную замену. С помощью mSwAP-In авторы создали мышей с человеческими генами белков TMPRSS2 и ACE2, играющих ключевую роль в инфекции SARS-CoV-2. Такие мыши могут быть моделью для изучения патофизиологии COVID-19.
Новая статья в Nature представляет метод mSwAP-In, позволяющий переписывать (авторы используют именно слово rewrite) большие участки генома млекопитающих, заменяя их синтетической ДНК. Это дает возможность вносить обширные изменения в геном — например, гуманизировать (заменять человеческими) те или иные локусы в геноме мышей.
Синтез геномов «снизу вверх», с нуля — перспективное направление фундаментальной и прикладной биологии. Функциональный синтетический геном микоплазмы (один из самых маленьких бактериальных геномов) еще в 2010 году получила команда Крейга Вентера. Позднее это было сделано и для кишечной палочки. Та же команда, что в новой работе модифицировала геном мыши, синтезирует геном дрожжей Saccharomyces cerevisiae и уже собрала все хромосомы (проект Sc2.0; доступен препринт статьи, которая сейчас готовится к публикации в Cell). Однако синтез полного генома млекопитающих остается невозможным из-за его сложности и размера. Промежуточным шагом может стать замена больших участков, охватывающих целые локусы с регуляторными областями и одним или несколькими близлежащими генами.
Во время пандемии COVID-19 были крайне востребованы животные модели инфекции. Из-за полиморфизма гена ACE2 у мышей изоляты SARS-CoV-2, полученные от человека, не могут эффективно их заражать. Трансгенные мыши с человеческим ACE2 также демонстрируют картину инфекции, не вполне соответствующую той, что наблюдается у людей. Так, мыши K18-hACE2, первоначально полученные для исследования вируса атипичной пневмонии (подробнее на PCR.NEWS), широко применялись и для изучения SARS-CoV-2, однако у них развивается тяжелая высоколетальная инфекция, не слишком сходная с COVID-19 у людей.
Большинство методов генной инженерии ограничены трудностями сборки, очистки и доставки ДНК в клетки млекопитающих, и чем протяженнее участок, тем это сложнее. Авторы адаптировали для замены больших участков в геноме млекопитающих метод, который создали для конструирования дрожжевого генома, и назвали его mSwAP-In (mammalian switching antibiotic resistance markers progressively for integration).
Для пошаговой замены участков генома на синтетические авторы создали два типа маркерных кассет (MC1 и MC2), каждая из которых содержит флуоресцентный маркер, подтверждающий, что встройка произошла адекватно, маркер положительного отбора и маркер отрицательного отбора. Кроме того, в них есть сайты-мишени, связывающие гидовую РНК CRISPR-Cas9.
Сначала с помощью CRISPR-Cas9 в геном встраивается MC1 недалеко от 5’-конца интересующего участка. Затем в клетку вводится конструкция, собранная в дрожжевых клетках; она содержит участок синтетической ДНК, которую нужно ввести в геном (авторы называют его «ассемблоном»), и на его 3’-конце MC2. В свою очередь, эта конструкция встраивается в геном, причем MC1 и фрагмент генома мыши заменяются синтетическим участком. Таким образом, получается геном со встроенными первым ассемблоном и MC2. Этот шаг можно выполнить повторно с аналогичной конструкцией, содержащей второй ассемблон и MC1 на его 3’-конце, и в принципе данную итерацию можно повторять сколько угодно раз. На каждом этапе положительный маркер новой кассеты позволяет отобрать клетки, в которых произошла встройка, а отрицательный маркер предыдущей кассеты — выявить и не отбирать клетки, в которых очередной ассемблон встроился не точно за предыдущим (не удалена предыдущая маркерная кассета).
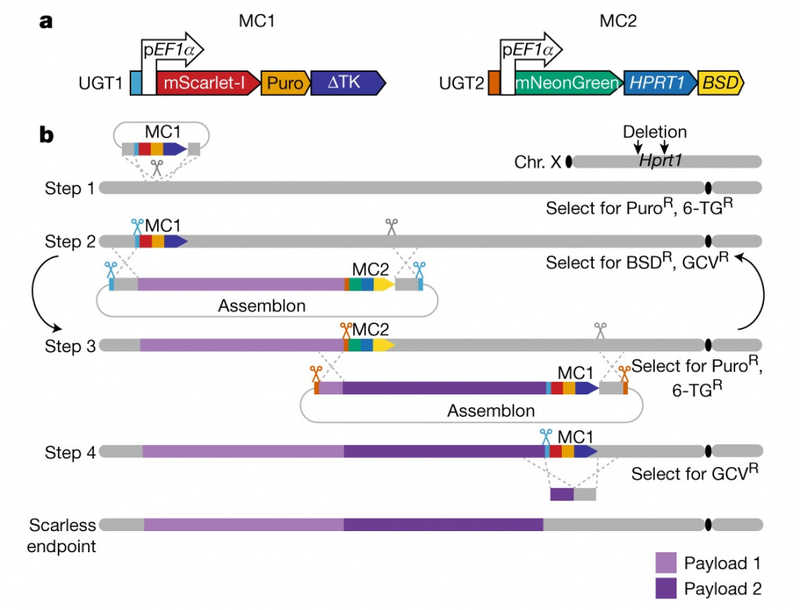 Принцип метода перезаписывания генома mSwAP-In. Credit: Nature (2023). DOI:
10.1038/s41586-023-06675-4 |
CC BY 4.0 DEED
Принцип метода перезаписывания генома mSwAP-In. Credit: Nature (2023). DOI:
10.1038/s41586-023-06675-4 |
CC BY 4.0 DEED
До пандемии COVID-19 авторы использовали метод mSwAP-In для модификации гена Trp53, который у мыши кодирует белок p53. Ученые перекодировали участки гена, часто мутирующие в раковых клетках, чтобы сделать его менее подверженным мутациям (ввели синонимические замены, снижающие количество динуклеотидов CG). Этот синтетический Trp53 (synTrp53) был внедрен в геном мыши, причем сохранял свою активность и вызывал стандартные реакции клеток на препарат доксорубицин. Кроме этого, synTrp53 был действительно менее подвержен мутациям по сравнению с геном дикого типа: после 38 пассажей в «горячих точках» модифицированного участка уровень мутаций оказался гораздо ниже.
Для создания более физиологичной модели инфекции SARS-CoV-2 у мышей авторы заменили с помощью mSwAP-In мышиный локус Ace2 на человеческий, включая все интроны и регуляторные элементы. Варианты человеческого гена ACE2 с длинами 116 кб или 180 кб внедрили в геном мышиных эмбриональных стволовых клеток (за один шаг) и получили мышей с человеческим ACE2. Этих мышей заражали дозами SARS-CoV-2 в различных дозах. Через три дня в их легких присутствовала вирусная РНК. Пневмония развилась как у ACE2, так и у K18-hACE2-мышей, однако у первых в более легкой форме. ACE2-мыши пережили инфекцию SARS-CoV-2 без потери веса или существенных симптомов. По сравнению с золотистыми хомячками (еще одной популярной моделью COVID-19) они показали более легкое течение болезни и более сходную с человеческой восприимчивость к трахеальной инфекции. В целом патофизиология COVID-19 у них была близка к человеческой.
«То, что эти мыши выживают, создает первую модель на животных, которая имитирует форму COVID-19, наблюдаемую у большинства людей — вплоть до активации клеток иммунной системы и сопоставимых симптомов», — сказал руководитель исследования Джеф Боке, директор Института системной генетики при Нью-Йоркском университете (США).
Чтобы проникнуть в клетку, SARS-CoV-2 помимо ACE2 использует трансмембранную сериновую протеазу 2 (TMPRSS2). Авторы также заменили в геноме ACE2-мышей ген Tmprss2 человеческим TMPRSS2. Животные, гуманизированные по обоим этим генам, могут еще более точно моделировать физиологию инфекции SARS-CoV-2 у человека, отмечают авторы. Для созданных ими линий мышей они предложили название «genomically rewritten and tailored genetically engineered mouse models» — GREAT-GEMMs.
Источники
Zhang, W., et al. Mouse genome rewriting and tailoring of three important disease loci. Nature. 2023. DOI: 10.1038/s41586-023-06675-4
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0