Препарат, применяемый при терапии болезни Паркинсона, вызывает дефицит железа у микрофлоры кишечника
Из-за плохой абсорбции и (или) недостаточной секреции желчи некоторые препараты могут попадать в толстый кишечник и взаимодействовать с его микробиотой. Исследование, опубликованное в Nature Microbiology, показало, что энтакапон, применяемый при лечении болезни Паркинсона, связывает ионы железа Fe(III). Это подавляет рост нормальной микрофлоры и одновременно стимулирует распространение патогенов, способных связывать железо с большим сродством благодаря их факторам вирулентности.
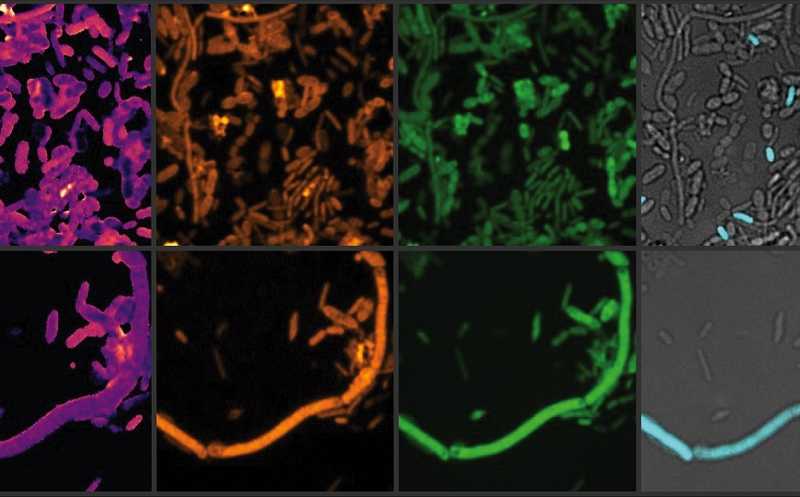
Визуализация активных кишечных микробов. После кратковременной инкубации с тяжелой водой, культуральной средой и лекарственным средством различные химические связи (здесь C-D и C-H) в образце стула показаны желтым и зеленым цветом, их соотношение — желто-фиолетовым (слева).
Credit:
Xiaowei Ge (Boston University) | Пресс-релиз
Появляется все больше информации о связи между кишечной микробиотой и состоянием здоровья человека. На микробиоту влияют не только антибиотики, но и другие лекарства, что может быть связано с появлением побочных эффектов. Для снижения их тяжести важно изучать особенности влияния лекарств на микроорганизмы. Например, предшественник дофамина леводопу применяют при терапии болезни Паркинсона. Энтакапон, ингибитор фермента катехол-О-метилтрансферазы (КОМТ), назначается совместно с леводопой, так как он предотвращает ее распад. Ученые из Австрии, Великобритании и США выявили негативное воздействие препарата энтакапона и локсапина (антипсихотика, применяемого при шизофрении) на микробиом кишечника. Исследование опубликовано в Nature Microbiology.
Авторы исследования оценивали влияние препаратов на микробиом с помощью суточной инкубации образцов кала шести здоровых людей с низкими и высокими концентрациями изучаемых препаратов. С помощью секвенирования ампликонов гена 16S рРНК и метода дробовика они исследовали изменение состава микробиоты. Высокая концентрация энтакапона (ENT-Hi) значительно снизила численность и изменила видовой состав микроорганизмов: снизилось количество представителей родов Alistipes, Anaerostipes, Blautia, Eubacterium, Fusicatenibacter, Roseburia, Streptococcus и семейства Erysipelotrichaceae, а Escherichia, Shigella и Ruminococcus стали встречаться чаще. Помимо этого, обе концентрации локсапина сукцината (LOX-Hi, LOX-Low) влияли на численность некоторых родов. В образцах с высокой концентрацией уменьшилось количество Bacteroides или Clostridium. LOX-Low повлиял на виды Erysipelotrichaceae spp., Oscillospiraceae spp. и Lachnospiraceae spp.
ENT-Hi воздействовал на 29,4% всех вариантов ампликонов. С помощью сравнения результатов анализа последовательностей ампликонов с данными метагеномного секвенирование методом дробовика было установило влияние ENT-Hi на рост E. coli и R. bromii. Полученные результаты свидетельствуют о более выраженном воздействии энтакапона на состав и численность микробиоты, влияние локсапина прослеживалось меньше.
Для оценки влияния препаратов на метаболизм микроорганизмов в инкубационные камеры добавили тяжелую воду (D2O), в состав которой входит дейтерий (D). Индикация и подсчет количества связей C-D, образующихся при включении дейтерия из D2O в микробные клетки, осуществили с помощью стимулированной спектроскопии рамановского рассеяния (SRS) в сочетании с флуоресцентной in situ гибридизацией (FISH). В отсутствие препаратов 98% проанализированных клеток было метаболически активно, а добавление ENT-Low, LOX-Low или LOX-Hi снижало долю активных клеток в общей массе и метаболическую активность отдельных клеток. Исследователи сосредоточились на следующих таксонах: E. coli, Clostridium sensu stricto 1, Streptococcus, Lactococcus, Phocaeicola dorei, Ruminococcus bromii, Bacteroides uniformis. Инкубация в условиях LOX-Low и LOX-Hi значительно снизила активность всех этих представителей микробиоты кишечника, кроме E. coli.
Образцы ENT-Hi показали сильный неспецифический рамановский сигнал, в связи с чем были исключены из предыдущего анализа. Ученые установили его причину — биоаккумуляция энтакапона в микробных клетках. Лекарственное средство в большей степени накапливался в P. dorei, Streptococcus spp. и E. coli, причем в случае первого таксона рост микроорганизмов замедлялся, а в случае последнего — стимулировался.
Далее было установлено, что нитрокатехоловая группа энтакапона может действовать как бидентатный лиганд, образуя стабильные трис-комплексы с ионом железа через атомы кислорода катехола. Авторы предположили, что ингибирующее действие препарата ассоциировано с его способностью связывать железо. Они инкубировали B. thetaiotaomicron с Fe(III) и с энтакапоном, связанным с железом (ENT-Hi:Fe). Это устранило ингибирующее действие ENT-Hi на культуру. То есть энтакапон связывает трехвалентное железо, необходимое микроорганизмам для роста и развития, вызывая дефицит железа. Результаты эксперимента подтвердились на микробиоте фекалий. Добавка железа не только позволяла расти таксонам, на которые негативно влияет энтакапон, но и, по-видимому, ограничивала вызванное препаратом ускоренное размножение E. coli.
Кишечная палочка способна синтезировать и выделять сидерофоры — низкомолекулярные вещества, связывающиеся с ионами Fe(III) и выделяемые микроорганизмами при дефиците ионов железа в окружающей среде. У E. coli обнаружено два вида сидерофоров — энтеробактин (энтерохелин) и аэробактин. Исследователи обнаружили, что энтеробактин хелатирует трехвалентное железо с гораздо более высоким сродством, чем энтакапон. Это и позволяет кишечной палочке извлекать и усваивать достаточное количество железа в условиях ограниченного его содержания. Выработка сидерофоров и поглощение железа обычно наблюдаются у патогенных штаммов, которые также могут кодировать и другие факторы вирулентности. ENT-Hi способствует увеличению количества генов, отвечающих за устойчивость к противомикробным препаратам и вирулентность и, соответственно, росту микроорганизмов с высоким патогенным потенциалом.
Следующий шаг для авторов исследования — изучение возможности модификации терапии при болезни Паркинсона, чтобы избежать столь выраженного негативного воздействия на микробиоту кишечника. Обеспечив достаточное поступление железа в толстый кишечник, можно уменьшить дисбактериоз и проблемы с желудочно-кишечным трактом, которые часто сопровождают лечение данного заболевания.
Суточные изменения кишечной микробиоты регулируют ответ организма на стресс
Источник:
Pereira F.C., et al. The Parkinson’s disease drug entacapone disrupts gut microbiome homoeostasis via iron sequestration. // Nat Microbiol (2024). DOI: 10.1038/s41564-024-01853-0


 Меню
Меню





 Все темы
Все темы




 0
0







