При раке могут образовываться иммуногенные вирусоподобные капсиды
Ген белка PNMA2 произошел от «одомашненного» ретротранспозона. Этот белок может спонтанно собираться в вирусоподобные капсиды. Обычно он экспрессируется только в мозге, но его также вырабатывают опухоли. Вирусоподобные капсиды из PNMA2 иммуногенны; аутоантитела против них могут атаковать нейроны, вырабатывающие этот белок. У мышей, которым ввели такие капсиды, возникли трудности в обучении и нарушения памяти.
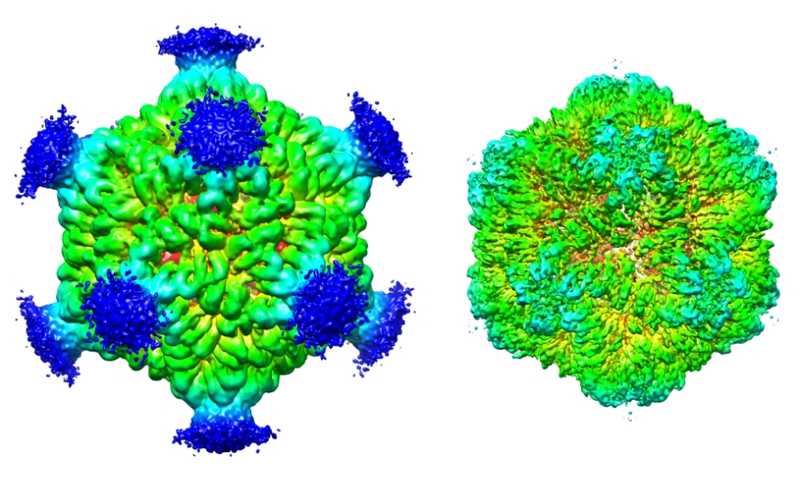
Известно, что некоторые белки, закодированные генами ретротранспозонного происхождения, сохранили способность образовывать вирусоподобные капсиды при выходе из клеток. Например, белок Arc, образующий такие частицы, участвует в обеспечении коммуникаций между нейронами. Arc относится к белкам, гомологичным gag — белку капсида ретровирусов, как и продукты генов PNMA1 и PNMA2. Их биологические функции неизвестны, однако в крови и спинномозговой жидкости пациентов с неврологическими паранеопластическими синдромами, сопровождающими некоторые виды рака, были обнаружены аутоантитела к белкам PNMA1 и PNMA2.
Авторы новой статьи в журнале Cell попытались выяснить роль вирусоподобных капсидов из белка PNMA2 в таких синдромах. Проведя филогенетический анализ гена PNMA2, они показали, что он произошел от ретротранспозона Ty3/mdg4 (ранее известного как Ty3/gypsy). У общего предка всех плацентарных млекопитающих этот ген появился около 100 миллионов лет назад. РНК-секвенирование разных тканей показало, что белок PNMA2 экспрессируется в нейронах гиппокампа и коры головного мозга млекопитающих, в меньшей степени — в олигодендроцитах и в глиальных клетках.
Затем ученые получили рекомбинантный белок PNMA2 в кишечной палочке и продемонстрировали, что он действительно может спонтанно собираться в вирусоподобные капсиды. При этом эксперименты на нейронах крысы в культуре показали, что такие капсиды выходят из клеток без мембранной оболочки. Обычно капсиды ретровирусов, а также вирусоподобные капсиды из белка Arc выходят из клеток с оболочкой, подобно внеклеточным везикулам. В то же время некоторые другие вирусы, в том числе аденовирусы и аденоассоциированные вирусы, тоже выходят из клеток без мембраны. Учитывая, что такие вирусы применяются в генной терапии, важно узнать механизм их выхода из клеток, а в качестве модели для таких исследований можно использовать капсиды из белка PNMA2, отмечают авторы.
Вирусоподобные капсиды из PNMA2 оказались иммуногенными. Когда мышам делали внутрибрюшинные инъекции очищенных рекомбинантных капсидов, и у них наблюдалась аутоиммунная реакция даже без использования адъюванта: в крови животных обнаруживались аутоантитела к PNMA2, которые распознавали шипы на поверхности капсидов. Если же мышам вводили мутантный белок PNMA2, неспособный собираться в капсиды, такой реакции не было.
Авторы детально охарактеризовали иммунный ответ, который запускался при введении мышам капсидов из PNMA2. Инъекции приводили к созреванию дендритных клеток, это, в свою очередь, способствовало выработке цитокинов, активирующих Т-клетки. Что интересно, такой каскад запускали и интактные, и мутантные белки PNMA2, хотя в последнем случае цитокинов вырабатывалось меньше. Эта разница может объяснять, почему в ответ на введение мутантных белков, не собирающихся в капсиды, у мышей не вырабатывались аутоантитела.
Эндогенные ретровирусы могут участвовать в развитии рака и нейродегенеративных заболеваний. Ученые предположили, что вирусоподобные капсиды из PNMA2 участвуют в развитии неврологического паранеопластического синдрома, при котором вырабатываются аутоантитела к PNMA2. Согласно их гипотезе, аутоиммунную реакцию может провоцировать выработка больших количеств PNMA2 опухолями вне ЦНС. Например, этот белок синтезируют некоторые опухоли легких и яичек. Так как обычно PNMA2 экспрессируется только в мозге, его обилие в других тканях способно вызвать аутоиммунную реакцию — иммуная система начнет атаковать и те участки мозга, которые вырабатывают PNMA2 в норме.
Когда мышам вводили рекомбинантные капсиды из белка PNMA2, у них развивались трудности с обучением и нарушения памяти. Однако у животных не было воспаления, которое характерно для пациентов с паранеопластическим синдромом. Соответственно, это заболевание нельзя смоделировать простыми инъекциями PNMA2 мышам. Кроме того, еще предстоит узнать, что именно приводит к возникновению неврологических симптомов при паранеопластическом синдроме: аутоантитела к PNMA2, иммунные клетки, проникающие в мозг, или оба фактора. Когда это будет выяснено, появится возможность подобрать лекарство, действующее направленно против антител или иммунных клеток.
Биологические функции PNMA2 в норме до сих пор остаются неизвестными, хотя, вероятно, они связаны с передачей сигналов между клетками в мозге. Ученые предполагают, что эти функции белку помогает выполнять его вирусоподобные свойства, как и в случае с белком Arc. Так как капсиды из PNMA2 не переносят в себе никаких нуклеиновых кислот, вероятно, в сигналинге принимают участие сами капсиды. Более подробное изучение таких сигнальных путей поможет лучше понять процессы, лежащие в основе межклеточных коммуникаций.
Ретротранспозон Lx9c11 контролирует иммунный ответ на вирусную инфекцию у мышей
Источник
Xu, J., et al. PNMA2 forms immunogenic non-enveloped virus-like capsids associated with paraneoplastic neurological syndrome. // Cell, 187, 1-15. 2024. DOI: 10.1016/j.cell.2024.01.009


 Меню
Меню





 Все темы
Все темы




 0
0








