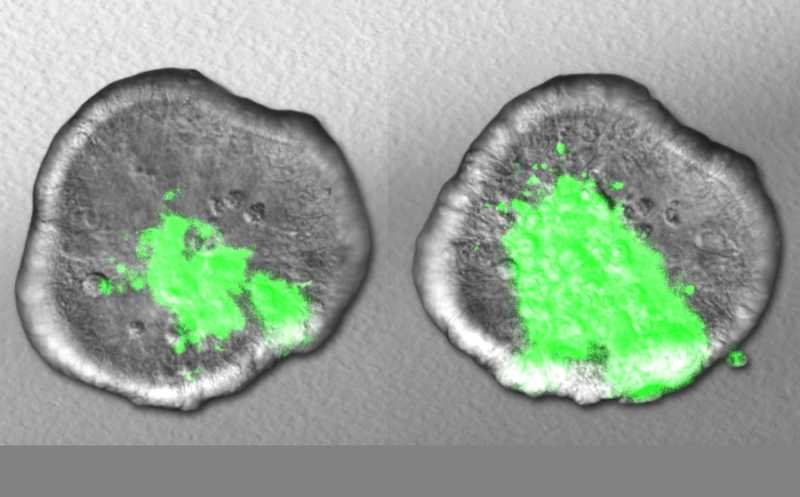
При успешной трансплантации фекальной микробиоты приживается 71% донорских штаммов
Трансплантация фекальной микробиоты — успешная стратегия лечения кишечных расстройств, вызванных Clostridioides difficile. Ученые из США разработали алгоритм для отслеживания отдельных штаммов бактерий в результатах метагеномного секвенирования и описали динамику микробиоты реципиентов в течение пяти лет после пересадки. Оказалось, что лучше всего приживаются представители Bacteroidales, а качество замещения микробиоты может служить маркером, предсказывающим успех лечения.
Нарушение нормального соотношения основных таксонов кишечной микробиоты может приводить к неприятным заболеваниям. Одно из таких нарушений — активное размножение бактерии Clostridioides difficile в толстом кишечнике. Это приводит к диарее, боли внизу живота и рвоте. C. difficile устойчива к большинству антибиотиков, поэтому один из способов лечения дибактериоза такого типа — пересадка каловых масс для восстановления нормального кишечного микробиома.
Несмотря на активное использование такой пересадки и ее несомненный клинический успех, детально изменение микробиома реципиентов после трансплантации до сих пор не изучалось. В новой работе ученые из США поставили перед собой задачу: на уровне отдельных штаммов описать, как изменяется микробиом кишечника реципиента каловых масс с течением времени.
В исследовании приняли участие семь здоровых доноров и 13 реципиентов, страдающих от заболевания, вызванного C. difficile. Образцы каловых масс реципиентов были взяты непосредственно перед трансплантацией, затем через 36 часов, 1 неделю, 4 недели, 8 недель, 6 месяцев, 1 год и 5 лет после процедуры.
Образцы анализировали с помощью метагеномного секвенирования. Чтобы выполнить поставленную задачу, ученые разработали новый алгоритм для статистической обработки метагеномных данных. Алгоритм, который назвали Strainer, позволяет отследить отдельные штаммы бактерий по уникальным коротким последовательностям их генома. Чувствительность и специфичность Strainer подтвердили на гнотобиотических мышах, кишечник которых заселяли бактериями из человеческих фекальных образцов, и на человеческих образцах.
При изучении динамики микробиоты в кишечнике реципиентов исследователи выяснили, что относительное количество резидентных штаммов (тех, которые преобладали в образцах реципиентов до трансплантации) уменьшается до 21% на восьмой неделе и далее остается почти неизменным. Наиболее сильно снизилась доля штаммов представителей Lactobacillales и Enterobacterales. Оказалось также, что 11,5% из прижившихся штаммов не обнаруживаются ни в донорских образцах, ни в образцах реципиентов до пересадки.
В основном приживались и оставались в кишечнике реципиентов в течение пяти лет донорские штаммы представителей Bacteroidales. Для реципиентов, у которых не происходило нормального и быстрого (в течение 8 недель) замещения микробиоты, то есть приживления 71% штаммов из донорской микробиоты, клиническая картина была негативной. Им требовалась повторная пересадка каловых масс для улучшения состояния. Это означает, что приживаемость донорских штаммов и степень вытеснения ими микробиоты реципиента является маркером быстрого выздоровления от инфекции, вызванной C. difficile.
По мнению авторов, определение штаммов донорской микробиоты, которые лучше всего приживаются у реципиента, может дать начало разработке альтернативной терапии инфекции C. difficile. Коктейль из бактерий, необходимых для выздоровления, в перспективе станет живым биотерапевтическим продуктом без фекальной составляющей.
Источник
Aggarwala, V, et al. Precise quantification of bacterial strains after fecal microbiota transplantation delineates long-term engraftment and explains outcomes. // Nature Microbiology 6, 1309–1318 (2021). Published 27 September 2021; DOI: 10.1038/s41564-021-00966-0


 Меню
Меню





 Все темы
Все темы



 0
0