Пять различных молекулярных сигналов в клетке можно наблюдать одновременно
При исследовании живой клетки с помощью флуоресцентных репортеров обычно в режиме реального времени удается визуализировать только два типа сигналов. Исследователи из MIT предлагают объединять сигнальные молекулы в кластеры, которые потом можно идентифицировать при помощи антител. Метод позволяет получать информацию одновременно о пяти молекулярных сигналах, и это не предел.
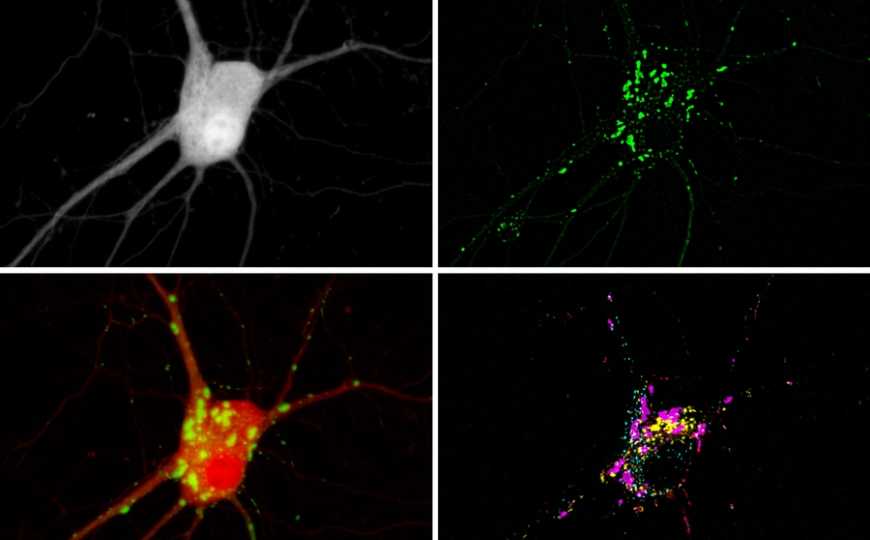
В каждый момент времени внутри живой клетки происходит множество событий. Например, изменяются концентрации Ca2+ , циклического АМФ (цАМФ), активность протеинкиназы A (PKA), Наблюдать за динамикой этих изменений можно с помощью флуоресцентных репортеров. Они могут быть связаны с разными компонентами клетки и позволяют отслеживать в режиме реального времени, как различные процессы влияют друг на друга. Проблема такого подхода в том, что микроскопы способны различить спектры ограниченного числа репортеров; обычно используется не более двух.
Исследователи из Массачусетского технологического института предложили качественно новый подход к этой задаче. Идея заключается в том, чтобы присоединить репортерные флуоресцентные молекулы к самособирающимся белкам, способным образовывать кластеры. Такие кластеры будут распределены внутри клетки случайным образом, наподобие островков, причем белки разных типов, несущие различные репортеры, кластеризуются только друг с другом. Предполагается, что разные кластеры будут достаточно далеко друг от друга, чтобы их можно было различить под микроскопом, и достаточно близко, чтобы можно было получить информацию о взаимодействии сигналов в живой клетке (см. рис. 1 в статье).
Даже если сигналы от кластеров будут неразличимы из-за перекрывания спектров флуоресцентных репортеров, потом препарат можно будет зафиксировать и использовать другие методы, которые нельзя применять на живых клетках (например, антитела к эпитопам, присоединенным к репортерам). Это позволит различить кластеры, местоположение которых останется неизменным.
Авторы подтвердили осуществимость своей идеи, использовав флуоресцентный репортер и самособирающиеся пептиды, которые формируют кластеры в пространстве клетки. Такие островки сигнальных репортеров (signaling reporters islands, SiRI), были получены для сенсоров на основе GFP, способных обнаруживать Ca2+, протеинкиназу А, цАМФ. Результаты использования этих SiRI по отдельности схожи с теми, которые демонстрируют такие сенсоры без пептидов.
После этих обнадеживающих результатов исследователи попробовали одновременно визуализировать Ca2+, протеинкиназу А, цАМФ. В нейронах экспрессировали сенсоры этих клеточных сигналов, связанные с самособирающимися пептидами. Клетки стимулировали веществом, оказывающем влияние на концентрацию и активность сигналов. Нейроны снимали в режиме реального времени, используя только один флуоресцентный фильтр — для детекции GFP. Затем клетки зафиксировали и обработали антителами, узнающими пептиды, прикрепленные к сенсорам. В результате получилась трехцветная картинка, позволившая отнести каждую точку (каждый кластер) в отснятой живой клетке к определенному типу сигналов.
Ученым также удалось расширить набор репортеров до пяти: они использовали также сенсор для протеинкиназы С и для внеклеточной активности киназ (уже с красным флуоресцентным белком). По их мнению, это не предел. Эдвард Бойден, руководитель работы, сотрудник Медицинского института Говарда Хьюза и MIT, говорит: «Потенциально вы можете смотреть на десятки, сотни или даже больше сигналов. Следующая задача — разместить сенсоры всех этих сигналов в клетке». Амбициозная цель, которую обозначает Бойден, — возможность «наблюдать за всем, что происходит в живой клетке, или, по крайней мере, за той частью, которая связана с обучением, или с болезнью, или с лечением болезни».
Источник
Changyang Linghu, et al. //. Spatial Multiplexing of Fluorescent Reporters for Imaging Signaling Network Dynamics.// Cell, 2020, DOI: 10.1016/j.cell.2020.10.035.


 Меню
Меню





 Все темы
Все темы




 0
0








