Сергей Ульянов: «Трехмерная геномика – очень молодая наука»
Лекторий «Метафаза» продолжает работу. Хватает ли ДНК места в ядре? Что нового известно о формировании транскрипционных комплексов? Что сближает гены и энхансеры в пространстве? На каком уровне трехмерной структуры ДНК происходит регуляция активности генов? Объясняет д.б.н. Сергей Ульянов, ведущий научный сотрудник Института биологии гена РАН.

Лекцию «Трехмерная геномика: как укладка ДНК управляет работой генов» в рамках научно-просветительского проекта «Метафаза» портала PCR.NEWS и Парка «Зарядье» прочитал доктор биологических наук Сергей Владимирович Ульянов, ведущий научный сотрудник Института биологии гена РАН.
Леска длиной в Черное море
Трехмерная геномика — это очень молодая наука. Сергей Владимирович подчеркнул, что практически вся озвученная в докладе информация была получена всего лишь за последние 5–10 лет.
Современную молекулярную биологию, которая связана с изучением ядра и генома, можно условно разделить на три основных раздела. Первый — стандартная геномика, ее можно понимать как анализ текста. Мы секвенируем геномы, получаем первичную последовательность и ищем в ней гены, регуляторные элементы и другие важные мотивы. Если данных много, то мы можем сравнивать их друг с другом и делать выводы об эволюции. Например, построим филогенетические деревья и поймем, кто кому родственен.
Второй слой, некая надстройка — это эпигеномика. Исторически сложилось так, что эта область развивалась раньше, чем полноценное секвенирование геномов. ДНК в клеточном ядре редко существует сама по себе — она всегда ассоциирована с белками, малыми молекулами, липидами. Весь спектр этих молекул и их химические модификации регулируют активность различных участков ДНК, определяют работу генов.
Трехмерная геномика, изучающая третий уровень организации генома, появилась в начале 2000-х годов. Если геномика занимается анализом текста, эпигеномика — анализом контекста, то трехмерная геномика сосредоточена на форме, которую генетический материал принимает в ядре клетки. Если попытаться визуализировать длинные молекулы ДНК в живой клетке, то мы увидим, что они сворачиваются по-разному: где-то плотнее, где-то менее плотно. Предмет изучения трехмерной геномики — это именно способ упаковки ДНК в ядре и влияние изменений в плотности этой укладки на активность генов. Первые наблюдения относительно укладки хроматина в ядре проводились и в начале 2000-х, но настоящий всплеск интереса к этой теме произошел около 2014-2015 гг. В это время началось стремительное накопление данных.
В каждой человеческой клетке содержится около двух метров ДНК толщиной примерно два нанометра. Если увеличить все размеры — толщину двойной спирали ДНК, длину генома человека и диаметр ядра клетки — так, чтобы ДНК стала не 2 нанометра, а 1 мм (например, как тонкая леска), общая длина генома составит около тысячи километров. Это сопоставимо с длиной Черного моря. И эта «нитка» уместится в сферу диаметром около шести метров, по размеру как небольшой автобус.
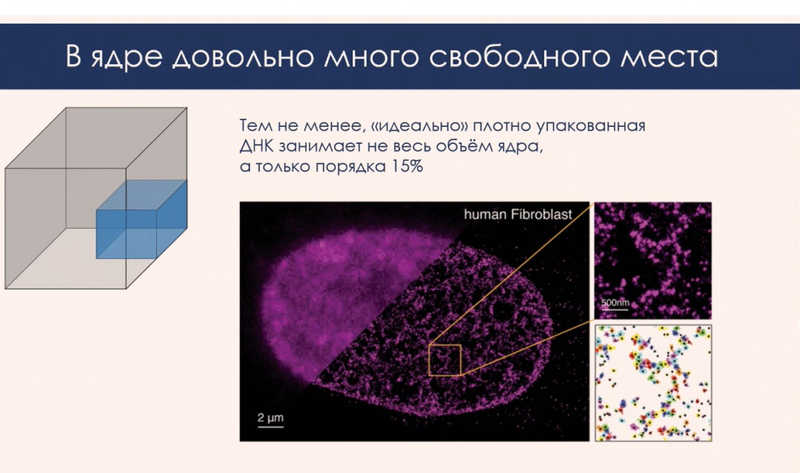
Более того, в ядре достаточно свободного пространства. Например, на изображении ядра фибробласта каждая сиреневая точка соответствует одной нуклеосоме. Это позволяет визуализировать отдельные фрагменты хромосом. Пространство без окраски указывает на отсутствие ДНК. Свободное место необходимо для обеспечения гибкости ДНК, чтобы она могла уплотняться или распаковываться и перемещаться между различными участками ядра. Все это имеет отношение к регуляции работы генов.
Нуклеосома и ее хвосты
Что компактизирует ДНК в ядре и создает различные пространственные структуры? Базовая структурная единица организации ДНК в клетках почти всех эукариотов — это нуклеосома. Она состоит из восьми молекул белков-гистонов, вокруг которых намотана ДНК. Нуклеосомы последовательно расположены вдоль хромосомы. Важное их свойство — исключительная консервативность. Можно выделить гистоны из клеток какого-нибудь организма, например, человека взять ДНК из клеток мыши, и в пробирке соберется нуклеосома, если соблюдать определенные условия, в частности, правильно подобрана ионная сила среды. Структура нуклеосом крайне схожа у всех эукариотических организмов.
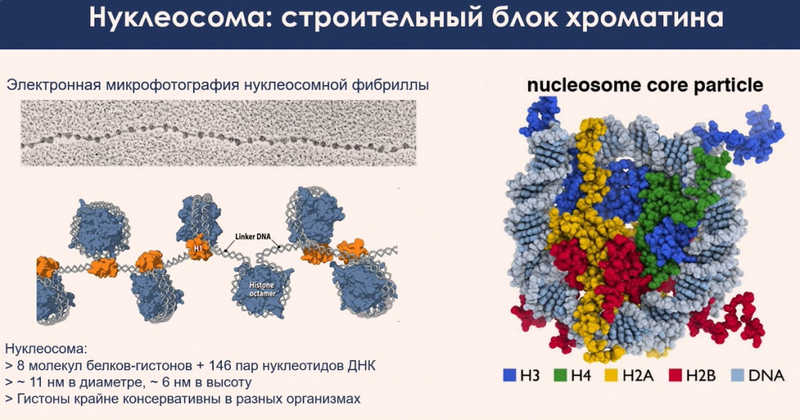
В нуклеосоме можно выделить две ключевые части: кор, вокруг которой обвита ДНК, и «хвосты» гистонов — неструктурированные домены белков, выступающие наружу. В живых клетках аминокислоты хвостов подвергаются различным химическим модификациям. Спектр этих модификаций служит материальной основой эпигенетики, поскольку от химического состояния хвостов гистонов зависит, будет ли ген транскрибирован или останется неактивным.
Основная часть нуклеосомы, содержащая ДНК, обладает сильным отрицательным зарядом. Хвосты гистонов заряжены положительно. Также имеется небольшой, но сильно отрицательно заряженный участок, известный в англоязычной литературе как acidic patch — в русском языке пока не сформировалось устоявшегося термина. Нуклеосомы могут взаимодействовать друг с другом электростатически. Они притягиваются друг к другу, формируя плотные структуры. Эти взаимодействия очень слабы, но благодаря высокой частоте расположения нуклеосом на ДНК (примерно каждые 150–200 пар оснований) совокупная сила притяжения становится существенной и определяет плотность укладки хроматина.
В тех участках, где гены активно транскрибируются, положительный заряд хвостов гистонов нейтрализуется из-за химических модификаций. В результате нуклеосомы перестают притягиваться и начинают отталкиваться друг от друга, что способствует расслаблению структуры хроматина. Долгое время считалось, что активные гены образуют десятинанометровую фибриллу, где нуклеосомы никак не взаимодействуют друг с другом, а неактивные складываются в тридцатинанометровую. Но в живых клетках регулярной тридцатинанометровой фибрилы не обнаружено. Наблюдаются неструктурированные образования, которые называют клатчами или нанодоменами. Такие расхождения между данными о больших молекулярных комплексах, полученными in vitro и in vivo, встречаются довольно часто.
Ламина и ядрышко
Укладку ДНК также обеспечивает ее взаимодействие с различными внутриядерными структурами. Одна из самых крупных таких структур — ядерная ламина, белковый слой, расположенный под оболочкой ядра. В клетках многих организмов, включая человека, есть протяженные области хромосом, которые в интерфазе постоянно контактируют с ламиной и находятся на периферии ядра. Они называются ламиноассоциированными доменами и содержат преимущественно неактивные гены. Поэтому ламинарное пространство часто рассматривается как репрессорный компартмент, где локализуются неактивные гены.
Еще одно важное место в ядре, где располагаются неактивные гены, — поверхность ядрышка. В ядрышке собираются рибосомные частицы и синтезируется рибосомная РНК. На его поверхности сконцентрировано множество ферментов, которые репрессируют транскрипцию, и сюда часто перемещаются неактивные гены. В итоге крупные хромосомы оказываются растянутыми между двумя точками фиксации: одним концом на поверхности ядрышка, другим — на периферии ядра, на ламине.
Активные генные районы располагаются ближе к центру ядра. Там они взаимодействуют с другими структурами — ядерными тельцами, в частности, спеклами. В спеклах происходит сплайсинг, удаление интронов из пре-мРНК. Активные гены часто локализуются вблизи этих областей.
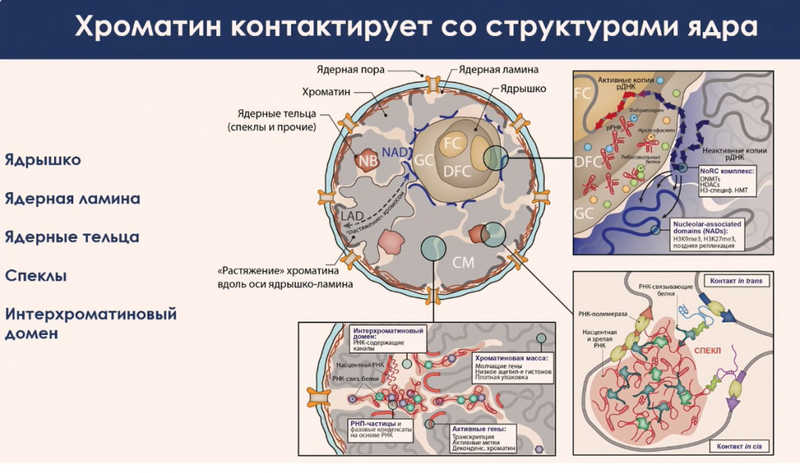
Если мы заглянем внутрь хромосомы, то увидим пористую структуру с системой каналов, которую называют «интерхроматиновый домен». Эти каналы начинаются от ядерных пор и проходят через всю хромосомную территорию, обеспечивая обмен веществами между ядром и цитоплазмой. Внутрь поступают регуляторные белки-предшественники, нуклеотидтрифосфаты, а наружу выходит новосинтезированная мРНК, которая в цитоплазме будет транслирована. Активные гены располагаются на поверхности этих каналов. Такое положение обеспечивает им доступ к РНК-полимеразе, другим регуляторным белкам и предшественникам РНК, поступающим из ядерной поры.
Поскольку в ядре много таких якорей, с которыми должны взаимодействовать различные фрагменты хромосом, это сильно влияет на укладку хромосомы и ее место в ядре. Например, хромосомы с большим числом ламиноассоциированных доменов обычно располагаются на периферии ядра. Это характерно для крупных хромосом. Меньшие хромосомы чаще занимают центральные положения, потому что содержат больше активных генов.
Энхансеры и петли
Что еще влияет на укладку хромосом? Это дальние точечные контакты между генами и регуляторными последовательностями ДНК, называемыми энхансерами. Они содержат кластеры мотивов связывания для транскрипционных факторов, которые регулируют активность генов. У высших многоклеточных организмов, включая человека, ген и управляющий его работой регуляторный элемент часто разделены достаточно длинным фрагментом ДНК. Это выглядит так же странно, как если бы директор завода находился на расстоянии 15 км от завода, сказал Сергей Ульянов. Но такая организация позволяет создать гибкую систему включения и выключения транскрипции. Особенно это важно для генов, которые должны активироваться на определенных этапах эмбриогенеза или в ответ на внешние стимулы, например, тепловой шок.
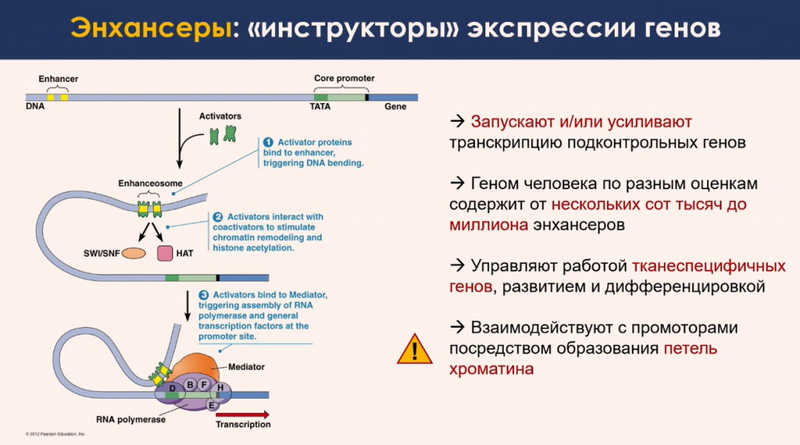
Такая быстрая активация гена происходит за счет образования петли, сближающей энхансер с геном в трехмерном пространстве ядра. Размер петель варьирует от десятков тысяч до миллионов нуклеотидов. Есть предположения о возможности транс-взаимодействия, когда регулятор расположен на другой хромосоме, но такие случаи требуют дополнительной проверки, так как могут оказаться результатом экспериментальных ошибок.
Формирование этих петель играет важную роль в тканеспецифической транскрипции, и крайне важно изучать его механизмы. В настоящее время по этому поводу предложены многочисленные гипотезы, которые можно разделить на два основных класса.
Первый класс — это модели экструзии: петля образуется за счет работы молекулярного мотора, который связывается с ДНК, протягивает ее через себя и формирует петлю.
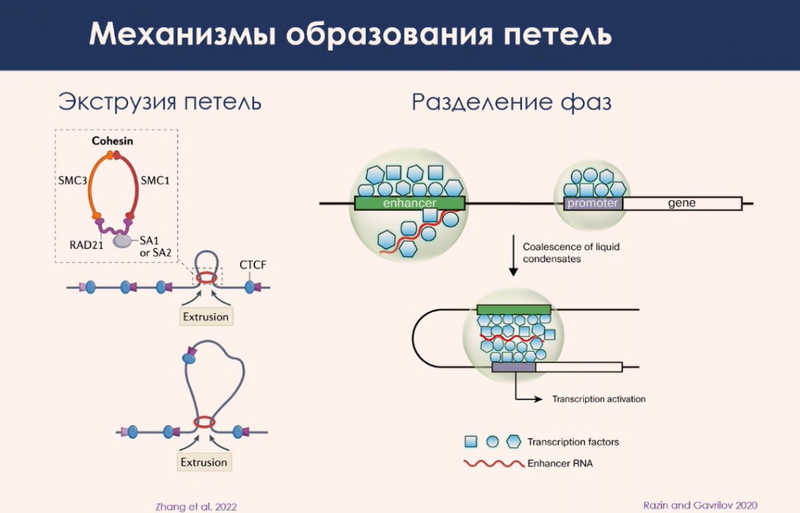
Второй класс моделей, более сложный, — образование петель за счет разделения фаз. Сергей Владимирович отметил, что в рамках такого подхода представление о базовых механизмах регуляции транскрипции в последние годы значительно меняется. Примерно пять-семь лет назад полагали, что связывание транскрипционного фактора с определенным мотивом ДНК привлекает дополнительные белки и включает транскрипцию. Теперь считается, что одно лишь связывание транскрипционного фактора с ДНК мало что дает. Однако оно привлекает другие молекулы, которые взаимодействуют друг с другом и с ДНК и формируют большую концентрацию регуляторных факторов в этом месте. Образуется белковая капля с высокой концентрацией активаторных факторов внутри. Именно это и стимулирует транскрипцию.
Такие белковые капли имеют поверхностное натяжение. Из-за этого они могут сливаться, если сталкиваются в пространстве. Когда две капли, одна из которых образовалась на промоторе, а другая на энхансере, встречаются в ядре, объединяются, усиливая регуляцию. Но экспериментальных данных по второму классу моделей пока очень мало, так как эта концепция развивается только в последние три-четыре года.
Кольца для ДНК
По первому классу моделей больше информации. Молекулярные моторы, которые обеспечивают связывание ДНК, протаскивание и замыкание петли между энхансерами и промоторами, называются SMC-комплексами (от англ. Structural Maintenance of Chromosomes). К этим комплексам относятся такие известные белки, как когезин и конденсин. Они необходимы во время деления клеток и способствуют поддержанию целостности сестринских хроматид после репликации. Когезин отвечает за сцепку хроматид, предотвращая их разъединение. Конденсины I и II участвуют в формировании характерной иксовидной структуры хромосомы в метафазе.
Эти белки традиционно рассматривались в контексте репликации и митоза. Но последние данные говорят о том, что они играют значительную роль в регуляции генов и поддержании стабильности хромосом в интерфазном состоянии. SMC-комплексы — удачное решение, найденное эволюцией. Они чрезвычайно консервативны и присутствуют у всех форм жизни, начиная от архей и бактерий и заканчивая человеком. Когезин и конденсины выполняют функции моторов, связываясь с ДНК и протягивая петли между энхансером и промотором, которые стабилизируются и замыкаются петли. В прокариотах аналогичные комплексы обеспечивают осевую компактизацию кольцевой ДНК.
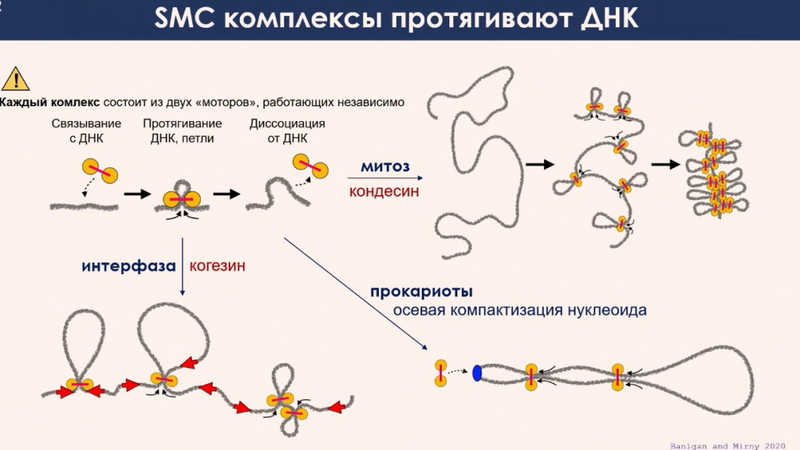
Обычно в учебных материалах и обзорных статьях для упрощения рисуют SMC-комплексы в виде открытых колец. Структурные данные говорят, что это промежуточное состояние, в котором комплекс находится короткое время. После очистки субъединиц когезина и конденсина и сборки их в комплексы in vitro криоэлектронная микроскопия показала, что они обычно находятся в сжатом состоянии: скручены во всех возможных местах, где молекула может сгибаться.
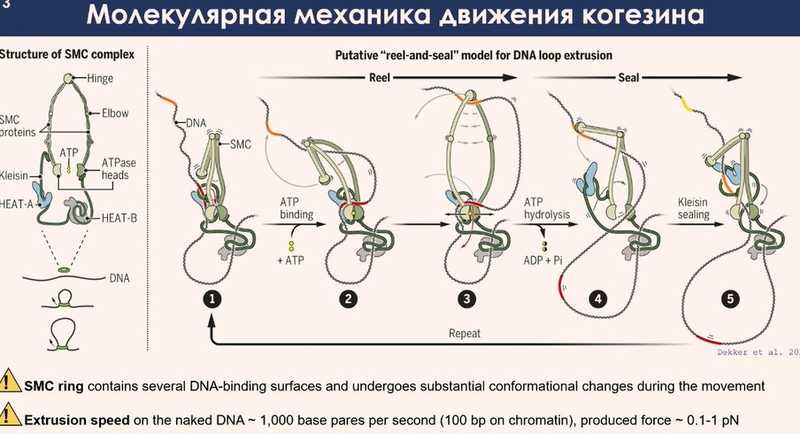
SMC-комплексы связываются с ДНК, находясь в компактизованном состоянии. Чтобы запустить процесс движения, необходим источник энергии — две молекулы АТФ, которые связываются с АТФазными головками. После этого происходят начальные конформационные изменения комплекса, открывая большую часть кольца, внутрь которого спонтанно проникает ДНК. Это неудивительно, потому что диаметр кольца около 40-50 нанометров, что намного превышает размер нуклеосомы. После этого ДНК неспецифически связывается с двумя точками на кольце — верхней и нижней. Предполагается, что эта связь очень важна для дальнейшего движения комплекса. Дальше кольцо раскрывается снизу за счет гидролиза молекул АТФ, АТФазные головки расходятся и ДНК проваливается внутрь еще глубже — комплекс делает шаг.
Скорость этого движения очень велика. Когезин и конденсин перемещаются по ДНК гораздо быстрее, чем любые полимеразы. Прямые измерения в чистой системе говорят, что скорость может достигать двух с половиной тысяч «букв» в секунду.
Откуда мы все это знаем?
Далее докладчик рассказал, как ученые изучают 3D-структуру генома. Первый класс подходов — это микроскопия. Существуют методы, позволяющие наблюдать разные аспекты укладки ДНК в ядре клетки. Самый простой — электронная микроскопия, которая показывает, что в клетке есть плотно уложенные участки ДНК (видны как черные пятна) и более рыхлые области. Можно также по-разному окрашивать ДНК, чтобы различать активные и неактивные регионы, отдельные участки хромосомы, и наблюдать, как они расположены в ядре. Можно окрасить не только саму ДНК, но и белки, которые с ней ассоциированы, например, гистоны и их модификации.
Ранее считали, что плотно уложенное состояние ДНК означает молчание гена, поскольку он недоступен для РНК-полимеразы и других белков. Однако сегодня выяснилось, что это упрощенное понимание. Прямые измерения показали, что скорость диффузии крупных молекул в плотно уложенных фрагментах ДНК и в рыхлой активной части генома практически одинакова.
Недостатки микроскопии в том, что, во-первых, даже у самых лучших современных микроскопов недостаточно разрешения, чтобы увидеть, что происходит на расстояниях порядка нескольких сотен или тысяч пар нуклеотидов. Во-вторых, флюорофоров разных цветов, которыми можно было бы покрасить ДНК и различные белки, не так уж и много — примерно два десятка.
Поэтому, для изучения пространственной структуры хроматина были разработаны биохимические методы. Они стали развиваться как раз начиная с 2002 года и называются C-методы, по названию первого из них — Chromosome Conformation Capture. Они разнообразны, но все они основаны на одном и том же базовом принципе.
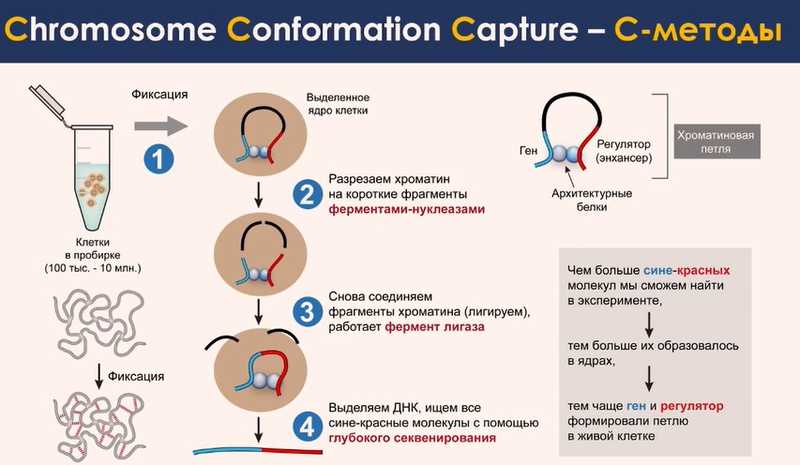
Процедура включает несколько этапов. Сначала живые клетки в среде роста или кусочек ткани фиксируют формальдегидом — он стабилизирует конформацию хромосомы ковалентными связями. Затем ядра извлекают из клеток и разрезают ДНК нуклеазами. Это дает возможность получить фрагменты ДНК, которые не рассеиваются из ядра и не отходят друг от друга, так как хромосома фиксирована. Следующий этап — обработка ДНК лигазой, который сшивает фиксированные фрагменты между собой. Эти фрагменты могли быть значительно удалены друг от друга в последовательности ДНК, но сближены в пространстве ядра. В результате получается химерная молекула ДНК, которой не было в живой клетке. Такие химеры можно секвенировать и считать. Если какая-то химерная молекула появляется в эксперименте чаще других, то и в живой клетке эти фрагменты часто локализуются вместе, и скорее всего, их близкое расположение имеет регуляторное значение.
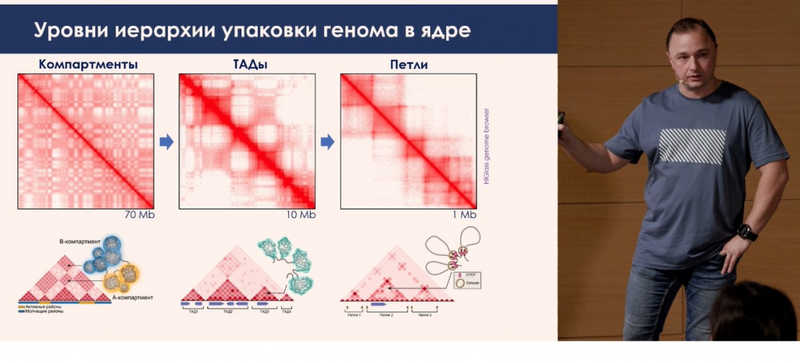
Результаты экспериментов представляют в виде таблиц, которые раскрашивают для наглядности в зависимости от числа контактов между двумя районами генома внутри огромного множества фрагментов (3 млн строк и 3 млн столбцов). Окрашивание такой таблицы будет неравномерным. Такие таблицы могут показывать фрагменты, внутри которых происходит очень много взаимодействий. Такие сгустки контактов называются топологически ассоциированными доменами. Это участки хромосомы, где сконцентрированы активные гены, которые могут регулироваться общими энхансерами и быть функционально связанными друг с другом.
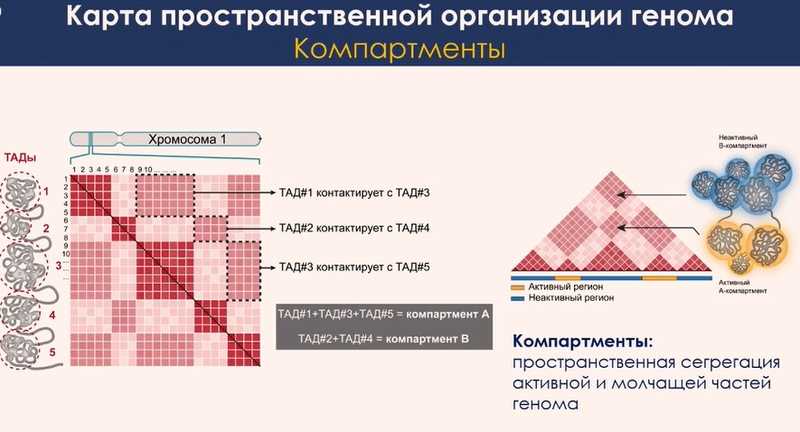
На картах заметно, что глобулы взаимодействуют друг с другом не случайным образом. Какие-то домены чаще вовлечены во взаимодействия, какие-то реже. Такое разделение топологических доменов на две группы соответствует пространственному разграничению активных и неактивных участков генома. Активные участки стремятся взаимодействовать с другими активными районами, а неактивные — с неактивными. Этот процесс называется компартментализацией. На микрофотографиях взаимодействие неактивных районов генома — это гетерохроматин, а взаимодействие активных — это эухроматин. В этом моменте микроскопия стыкуется с биохимией.
В завершение выступления Сергей Владимирович свел вместе все данные о картировании топологии генома. Есть несколько уровней организации ДНК. На уровне всей хромосомы и даже ядра как целостной структуры есть разделение в пространстве активных и неактивных районов — это компартменты. На более локальном уровне (сотни тысяч или миллионы пар нуклеотидов) хромосомы устроены как последовательность слабо структурированных «клубков». Третий уровень — точечные петлевые взаимодействия между генами и регуляторными элементами. Этот уровень укладки наиболее чувствителен к уровню транскрипции, именно здесь чаще всего происходит регуляция. Если положение топологических доменов и компартментов может быть сходным среди различных типов клеток, то точечные взаимодействия между генами и регуляторными элементами уникальны для каждой клеточной линии. Благодаря этим взаимодействиям регуляторы находят свои гены и активируют их.
В конце лекции слушатели задали вопросы. Один из самых актуальных вопросов, в том числе и для научного сообщества — наследуется ли 3D-организация генома. Сергей Владимирович ответил, что согласно общепринятной точке зрения пространственная организация стирается в ходе митоза. В митотической хромосоме нет ТАДов, компартментов и петель, потому что белки, которые их образуют, уходят. Но осенью этого года появился препринт, авторы которого на основании экспериментальных данных утверждают, что по крайней мере часть компартментной структуры проходит через митоз, не разрушаясь.


 Меню
Меню





 Все темы
Все темы




 0
0






